Stolling
Table of Contents
1 Onderzoek
1.1 Primaire hemostase
- trombocyten
- na week geen NSAID's:
- PFA
- aggregatietesten
- FP bij trombopenie <100
- "reversibel" is afwijkend bij een plaatjestest
- ATP/ADP-ratio
- toegenomen ratio en verlaagd ADP: storage defect
- discussie of alleen verhoogde ratio genoeg is voor diagnose
- geen perfecte specificiteit
- 90 genen panel UMCU (formulier)
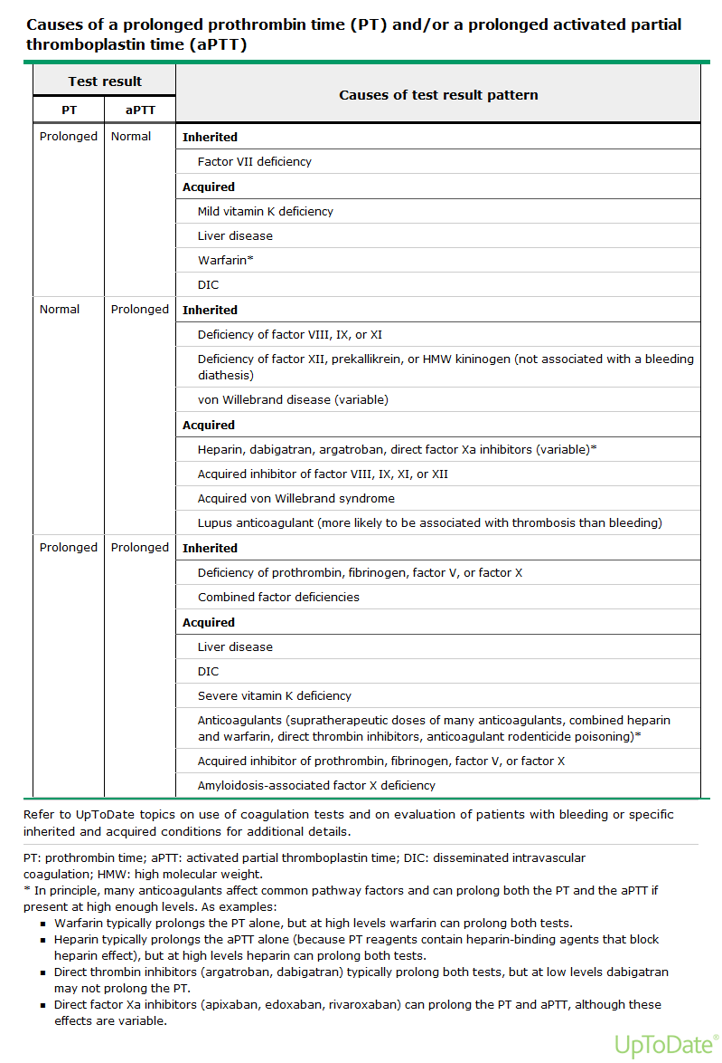
1.2 Secundaire hemostase
2 Risico-scores
2.1 CHA2DS2-VASc
- kans op CVA bij AF
Clinical criteria
Female Sex 1 point Age 65 to 74 (1 point), ≥75 (2 points) Heart failure 1 point Hypertension 1 point Diabetes mellitus 1 point History of stroke, TIA, or thromboembolism 2 points Vascular disease (history of MI, PAD, or aortic atherosclerosis 1 point - Risk
| 0 points: | 0.2% per year |
| 1 point: | 0.6% per year |
| 2 points: | 2.2% per year |
| 3 points: | 3.2% per year |
| 4 points: | 4.8% per year |
| 5 points: | 7.2% per year |
| 6 points: | 9.7% per year |
| 7 points: | 11.2% per year |
| 8 points: | 10.8% per year |
| 9 points: | 12.2% per year |
2.2 HESTIA
- checklist thuisbehandeling longembolie
- indien 1 aanwezig niet thuis (ook in afwachting CT)
- hoog risico op bloeding?
- gastro-intestinale bloeding in de afgelopen 14 dagen
- recent herseninfarct (<4 weken geleden)
- recente operatie (<2 weken geleden)
- stollingsstoornis of trombopenie (trombocyten <75 x 109/l)
- ongecontroleerde hypertensie (systolische bloeddruk >180 mmHg of diastolischebloeddruk >110 mmHg)
- O2-behoefte
- al voor begin klachten antistolling
- ernstige pijn
- sociale indicatie
- eGFR<30 ml/min
- ernstige leverfunctiestoornissen?
- zwanger
- HIT
- hoog risico op bloeding?
2.3 Criteria ziekenhuisopname bij DVT
- <18 jaar
- bedreigd been (phlegmasia coerulea dolens)
- sterk verhoogd bloedingsrisico (bijvoorbeeld TR <50, recent bloeding, ernstige HT, leverfunctiestns)
- kreatinineklaring <30 mL/min
- extreem overgewicht (BMI >50 kg/m2 en/of gewicht >150 kg).
6.(psycho-)sociale redenen waardoor thuisbehandeling niet mogelijk is.
2.4 Wells' score DVT
- <2 DVT onwaarschijnlijk, ≥2 DVT waarschijnlijk
- 1 Lokale gevoeligheid/pijn in gebied diep veneuze systeem
- 1 Recente immobilisatie langer dan drie dagen en/of operatie in voorgaande vier weken
- 1 Paralyse, parese of recent gipsverband aan het been
- 1 Pitting oedeem meer uitgesproken in symptomatische been
- 1 Zwelling gehele been
- 1 Collaterale oppervlakkige venen (geen varices)
- 1 Maligniteit of (palliatieve) behandeling in laatste zes maanden
- 1 Omvang kuit ≥3cm tov asymptomatische zijde (10cm onder tuberositas tibiae gemeten)
- -2 Alternatieve diagnose ten minste even waarschijnlijk
2.5 Risicofactoren VTE
- Immobilisatie
- Operatie
- VTE in voorgeschiedenis
- Maligniteit
- Hormonale anticonceptie (combinatiepil) of orale hormonale substitutietherapie
- Zwangerschap of kraambed
- Positieve familieanamnese
- Bekende trombofilie
- VTE bij pilgebruik is ΅uitgelokt”
3 VTE
3.1 Eerste lijn
- huisartsen hanteren eigen gevalideerde beslisregel met D-dimeer
- tromboflebitis: behandeling door huisarts indien niet tot inmonding diepe systeem
- in de DD pulmonale pathologie: longarts
- praktische informatie aanvraag spoed echo: kantooruren 8689901, buiten via receptie ziekenhuis 8688765 (dd rö-laborant)
3.2 Onderzoek
- VG
- mechanische hartklep → geen NOAC
- bloeding(srisico) / CI antistolling?
- maligniteit → duur antistolling
- andere RF trombose → duur antistolling
- vruchtbare vrouw: zwangerschapswens / zwanger / borstvoeding → geen NOAC/VKA/fonda
- Rx
- reeds antistolling?
- OAC → door tot 1 cyclus voor einde antistolling
- antistolling doet protrombogene effect teniet
- antistolling teratogeen
- beperkten bloedverlies
- LO
- controles:
- RR of shock → trombolyse overwegen
- saturatie of extreem overgewicht → opname
- bedreigd been → trombolyse?
- controles:
- LAB
- tr-penie en stolling (contraindicatie antistolling), lever/nier (dosisaanpassingen)
- bij verdenking recidief D-dimeer: laag, dan recidief minder waarschijnlijk (niet gevalideerd)
- scores
- DVT: Wells, na diagnose HESTIA
- LE: Years (Van der Hulle et al.), na diagnose opname-criteria
3.3 Kous
- medivenstruva tot de lies
- daarna aanmeten bij Streutker tot de knie
- indien niet mogelijk: via dermatoloog binnen 24 uur
3.4 Therapie
- 5 dagen LMWH waarna NOAC
- recidief onder antistolling
- klopt diagnose?
- HIT?
- veneuze compressie door massa's
- actuele INR: niet goed ingesteld geweest
- anti-Xa: compliance / interacties
- VKA-falen: over op LMWH
- LMWH-falen: + 25% dosering, daarna anti-Xa-spiegel en/of 2dd
- HOKUSAI: dexoxaban vs LMWH; CARAVAGGIO: apixaban vs LMWH
- klopt diagnose?
- duur behandeling
- maligniteit: in principe levenslang of tot 3 maanden na curatie maligniteit
- 1e optreden
- uitgelokte trombose: 3 maanden behandeling
- idiopathische DVT: optimale behandelingsduur onzeker
- zowel langdurige antistolling als 3 maanden antistolling te verdedigen
- voorkeur langdurig: bij man
- voorkeur kortdurend: bij vrouw met negatieve D-dimeer na 1 maand antistolling
- indien langdurig: bij toename bloedingsrisico opnieuw afwegen
- overige afwegingen
- al dan geen symptomatische PE als uiting ook overweging
- proximaal (vs distaal) 2x hoger risico recidief
- bloedingsrisico, persoonlijke opinie patient
- onderbouwing
- kans recidief tijdens behandeling erg laag (Boutitie, 2011)
- na stoppen behandeling 30% met vijf jaar
- hangt niet af van duur van behandeling mits >3 maanden
- risicofactoren recidief (Prandoni, "Provoked versus unprovoked"): mannen (75% hogere kans), Oudere leeftijd, Overgewicht, Positieve D-dimeer na behandeling, Vroege manifestatie post-trombotisch syndroom, Resttrombose (2x), NIET: positieve FA of trombofilie
- risico op ernstige bloedingen tijdens VKA 3% per jaar (Iorio, 2010)
- risico op mortaliteit door trombose of bloeding klein
- geen verschil met langdurige versus kortdurende antistolling
- recidief: altijd onbepaalde tijd, hoog bloedingsrisico in ieder geval 3 maanden
- poliklinisch
- bij vrouw D-dimeer na maand therapie: kans op recidief.
- screening op onderliggende maligniteit
- alleen anamnese en lichamelijk onderzoek.
- laagdrempelig overwegen: rectaal toucher, X-th, sediment, PSA, etc.
- echo DVT na 3 maanden als "uitgangsecho" voor bij verdenking recidief.
- indien relevant: stoppen met roken, afvallen.
- liever niet testen op trombofilie (erfelijk)
- echter ook bij geen deficientie indicatie voor niet VTE-risicoverhogende anticonceptie
- te overwegen bij 1e VTE en zus/dochter met kinderwens: vanwege kraambed
4 Antistolling
4.1 Bloeding onder antistolling
- fataal
- 90% door hersenbloeding
- antidota dan nauwelijks effect prognose ondanks stollingscorrectie
- 50% overlijdt in 1e maand, 25% levenslang geinvalideerd
- 0,3% / jaar bij VKA, 0,16% bij DOAC
- 90% door hersenbloeding
4.2 Bridging
– liever onderbreken dan overbruggen (riskant: Bridge, NEJM)
4.3 LMWH
- LMWH passeert de placenta niet
- 30% delayed type IV overgevoeligheidsreactie > switch
- indien >1 week LMWH: TR na 1 week
- routinematig anti-Xa spiegels niet nodig
- wel:
- nierschade (<30 mL/min) niet te voorspellen accumulatie, richtlijn UFH)
- zwangerschap (NVOG 2009: geen anti-Xa-spiegels)
- extreme obesitas (>50 kg/m2)
- anti-Xa top spiegel vier uur na toediening
- streefwaarde
- eenmaal daagse toediening 1,0 tot 2,0 U/ml
- tweemaal daagse toediening 0,6 tot 1,0 anti-Xa U/ml
- wel:
4.4 NOAC's
- NF-stns en LF-stns beinvloeden werking alle middelen
- xaban (= Xa-remmers)
- fondaparinux (Arixtra)
- subcutane Xa-remmer.
- 2,5 mg s.c. 1dd, bij klaring 20-50 ml/min 1,5 mg 1dd.
- OVT: 30-45 dagen.
- subcutane Xa-remmer.
- rivaroxaban (Xarelto)
- VTE: 15 mg 2×/dag gedurende dag 1–21, daarna 20 mg 1×/dag
- bij matige of ernstige (15–49 ml/min) nierinsufficiëntie: idem
- overweeg alleen op strikte indicatie verlaging onderhoudsdosering naar 15 mg 1×/dag
- AF:
- 20 mg 1×/dag.
- bij matige (30–49 ml/min) of ernstige (15–29 ml/min) nierinsufficiëntie 15 mg 1×/dag
- profylactisch: 10 mg 1×/dag, initiële dosis 6–10 uur na operatie
- heupoperatie 5 weken, na grote knie-operatie 2 weken
- VTE: 15 mg 2×/dag gedurende dag 1–21, daarna 20 mg 1×/dag
- apixaban (Eliquis)
- dag 1 t/m 7: 2dd 10 mg en vanaf dag 8: 2dd 5 mg
- fondaparinux (Arixtra)
- tran (= trombineremmers)
- dabigatran (= Pradraxa)
- AF: 2dd 150 mg beter dan VKA en minder bloedingen
- 2dd 110 mg indien >= 80 jaar of verapamilgebruik
- bij vertraagde klaring verlaagde dosis:
- matig ernstige nierfunctiestoornis (creatinineklaring 30–50 ml/min)
- ouderen (> 75 j.)
- comedicatie met sterke P–glycoproteïne–remmers zoals amiodaron, kinidine of verapamil
- bij verhoogde kans op bloedingen (gastritis, oesofagitis of gastro–oesofageale reflux)
- verlaagde dosis: 220 mg –> 150 mg 1×/dag
- 2dd 150 mg –> 2dd 110 mg
- bij 2 factoren: 220 mg –> 75 mg/dag
- e.e.a. afhankelijk relatieve risico's bloeding en trombose
- AF: 2dd 150 mg beter dan VKA en minder bloedingen
- dabigatran (= Pradraxa)
- contra-indicaties NOAC
- zwangerschap of borstvoeding
- gelijktijdig gebruik imidazolen of HIV proteaseremmers
- mechanische hartklep
- eGFR <30 ml/min
4.5 VKA
- LMWH ~ >4 dagen en tot 2x INR >2.0
- start acenocoumarol 6-4-2 mg eerste 3d, daarna via trombosedienst, INR op dag 3 of 4
4.6 Heparinepomp
- er bestaan indicaties voor een heparinepomp, met name omdat LWMH
- niet gecoupeerd kan worden
- niet bij klaring <20 ml/min gegeven kan worden
- vb:
- postoperatief bij reele kans op bloeding
- acute behandeling VTE bij nierfunctiestoornis
4.7 Trombocytenaggregatie
- even grote kans op complicaties als bij VKA
5 Tromboseprofylaxe
- Padua score ≥4, duur: de duur van immobilisatie of opname
- LMWH is hierbij het middel van eerste keus; fondaparinux alternatief
- contra-indicatie: bloeding of de aanwezigheid van meerdere risicofactoren voor bloeding
- overweeg dan mechanische profylaxe met elastische compressie kousen
- covidprofylaxe
- hoogste risico op trombose na grote orthopedische operaties en met name na heupoperatie: 2% DVT en 1% LE eerste 1-2 weken, na 7 weken in totaal 5%
- profylaxe
- 28-35 dagen, >6 uur na operatie
- bij modernere middelen registratietekst
- bij uitstel operatie (en daardoor immobilisate) >12 uur preoperatief LMWH
- totale heup- of knieprothese: LMWH, alternatief evenwaardig fondaparinux
- apixaban, dabigatran of rivaroxaban bij geen heupfractuur
- niet bij
- artroscopie knie, overweeg LMWH (zeven dagen) bij voorgeschiedenis van VTE
- gipsimmobilisatie
6 OAC en trombose
- bij positieve FA 1e graads familie lid of trombofilie of doorgemaakte trombose
- geen VTE-risicoverhogende anticonceptie
- postpartum 1e 12 weken sowieso geen OAC
- staken OAC: 1 cyclus vóór stoppen antistolling
- orale hormonale anticonceptie die het risico op VTE niet belangrijk verhoogt
- levonorgestrel spiraal (met zekerheid!)
- pil met alleen desogestrel
- bij voorkeur voor combinatiepil
- tweedegeneratie (levonorgestrel)-pil met maximaal 30 mcg ethinylestradiol
- na overweging FA (aantal familieleden), specifieke defect en leeftijd
- uitsluitend bij hoge uitzondering en met voorlichting over het sterker verhoogde VTE-risico
- pil voor met andere progestagenen, te weten gestodeen, desogestrel, cyproteronacetaat en drospirenon
- de hormoonpleister, vaginale ring, of prikpil
- alternatief: koperhoudend spiraal of sterilisatie?
6.1 Risico's
- VTE-risico normaal 0,01%/jr
- in overgang hoger basisrisico dan bij OAC (door leeftijd 50-55: 1 per 1000 vrouwjaren)
| factor | RR |
|---|---|
| combinatiepil | 4 |
| trombofilie | tabel (bij geen positieve FA risico's lager) |
| combinatiepil plus trombofilie | bij f.V-Leiden van 5 naar 28 per 10.000 vrouwjaren |
| belaste familiegeschiedenis | 2 (tot 4 bij meerdere familieleden) |
| overgewicht | 1,7) |
| obesitas | 2,4 maar 24 bij ook OAC |
| roken | 1,4 maar 8 bij OAC |
| kraamperiode | 12 eerste 6 weken, daarna RR 2 tot 12-18 weken daarna) |
| hormoonsuppletie in overgang | 2-3 (meer bij doorgemaakte trombose) |
6.2 Overgang
- transdermaal te overwegen bij positieve FA of trombofilie of doorgemaakte VTE: lijkt risico niet belangrijk te verhogen
- ook niet bij combinatie met Progestin, wel bij combinatie met Norpregnane-derivaten
- tibolon (oestrogeen, progestageen, androgeen)
- verhoogd risico op endometriumcarcinoom, mammacarcinoom en bij oudere vrouwen op een CVA
- geen verhoogd tromboserisico
6.3 OAC
- combinatiepreparaat
- oestrogenen: cyclusregulerend, protrombogeen
- 20-50 ug ethinylestradiol
- bij derde generatie bepaalt dosis tromboserisico
- progestageen: anticonceptief
- zonder oestrogeen niet protrombogeen bij desogestrel 75 ug, norethisteron
- eerste generatie: norethisteron, lynesteron
- tweede generatie: levonorgestrel, veiligst (RR 2.2, dan maximaal 20 ug ethinylestradiol)
- derde generatie: desogestrel, gestodeen (RR 4,2)
- overig: cyproteronacetaat, drospirenon (RR 4,1 - 4,5)
- oestrogenen: cyclusregulerend, protrombogeen
- niet-oraal
- prikpil (medoxyprogresteronacetaat): OR 3,6
- pleister RR 7,9
- vaginale ring RR 6,5
- implantatiestaafje RR 1,4 (maar effect niet uitgesloten)
7 Stollingsziekten
7.1 Ziekte van Von Willebrand
7.1.1 Kliniek
- kan zich op alle leeftijden uiten
- FA
- zwangerschap vermindert vaak behoefte aan therapie
- bloedingsanamnese
- epistaxis >10 min
- makkelijk blauwe plekken
- nabloeden na kiesextractie, menstruatie en peripartum of chirurgie (met name slijmvliezen zoals tonsillectomie)
- verworven von Willebrand syndrome
- op latere leeftijd bloedingen; eerder normaal beloop chirurgie
- negatieve FA
- remission na therapie oorzaak
- respons op IVIG (IgG MGUS-associated aVWD)
- weinig respons op VWF of desmopressine
7.1.2 Diagnostiek
- Plasma VWF:Ag
- Plasma VWF:Act (ristocetin cofactor activity, VWF:RCo and VWF collagen binding, VWF:CB)
- FVIII
- bij verdenking: remmer
- blijvende verdenking: herhalen
- "low VWF" (versus type 1 VWD)
- milde symptomen
- VWF:Act en Ag >=30 IU/DL
- weinig erfelijk
- classficatie
- VWF multimeerpatroon (gel electrophoresis)
- Ristocetin-induced platelet aggregation (RIPA)
- DDAVP-test when the patient is not bleeding
- in all patients with type 1
- most patients with type 2
- but not those with type 3 disease
7.1.3 Therapie
- DDAVP (i.v. of nasaal bij eerder bewezen respons)
- kleine bloeding of chirurgie
- von Willebrand factor (VWF) concentrate (plasma-derived or recombinant)
- major bleeding
- major surgery
- no response to DDAVP
- need for therapy longer than three days
- antifibrinolytic agents
- topical hemostatic agents
- estrogen
- recombinant factor VIIa
- zwangerschap: VWF >50 IU/dL tijdens bevalling tot 3-5 dagen postpartum
- dan regionale anaesthesie mogelijk
7.1.4 Classificatie
- type 1, partiele deficientie, 2/3 mutaties bekend
- 75%, autosomaal dominant, symptomatisch tot ernstig
- subtype (1C) met snelle klaring: snelle daling na DDAVP, hoog ratio propeptide:VWF
- diagnostiek:
- concordant reduction in VWF antigen, ristocetin cofactor activity, and factor VIII activity; factor VIII activity may be slightly higher than VWF levels
- All VWF multimers are present, although in decreased concentration
- RIPA is impaired only if VWF levels are sufficiently low (eg, moderately severe type 1 VWD)
- type 2, kwalitatief afwijkend vWF
- type 2A, 10-15%, voornamelijk kleine moleculen
- meestal autosomal dominant trait, matig tot ernstig
- afname hemostatically active high and intermediate molecular weight multimers of VWF
- some mutations cause a defect in the intracellular assembly and transport of normal VWF multimers (group 1)
- others affect a normal cleavage site in VWF and cause increased susceptibility to proteolysis by the VWF-cleaving protease (ADAMTS13) after secretion (group 2)
- diagnostiek
- Ristocetin cofactor activity / VWF:Ag levels lower than <0.5 to 0.7
- antigen may remain within the normal range
- Factor VIII levels may be normal or reduced
- VWF multimeren: absence of the high and intermediate molecular weight multimers
- RIPA reduced
- type 2B, "gain of function" in VWF: trombopenie
- klassiek
- 5%, autosomal dominant trait, moderate or moderately severe bleeding
- binding more readily to platelet receptor, glycoprotein Ib
- in some patients thrombocytopenia due to clearance or sequestration of platelet aggregates
- a few type 2B patients have normal multimer patterns at baseline.
- diagnostiek:
- VWF:Ag > ristocetin cofactor activity
- RIPA "increased" (aggregation is present at low concentrations of ristocetin): abnormal VWF binds to platelets at lower concentrations of ristocetin (<0.6 mg/mL) than does normal VWF
- Factor VIII may be normal or decreased.
- The multimer pattern: decrease in the high molecular weight multimers, often less severe than in type 2A VWD
- specialized assays that measure the direct binding of VWF to platelet GPIb in the presence of very low concentrations of ristocetin also show the gain of function in type 2B VWD, but the assays are not generally available [92,93].
- Platelet-type VWD
- "gain-of-function" mutations in platelet GP Ib, called platelet-type or pseudo VWD
- distinction can be made by mixing patient platelets with normal plasma VWF, and patient plasma VWF with normal platelets to perform the RIPA
- the special Platelet Binding assay using low concentrations of ristocetin and gene mutation studies can also differentiate between type 2B and platelet-type VWD
- klassiek
- type 2M, "loss of function"
- uncommon, mostly autosomal dominant
- reduced binding of VWF to GP Ib and the presence of a normal distribution (but decreased quantity) of VWF multimers
- diagnostiek:
- Ristocetin cofactor is reduced more than VWF:Ag (ratio <0.5 to 0.7)
- The full spectrum of VWF multimers is present, but all multimers are decreased in quantity
- The factor VIII level is reduced if the VWF is sufficiently low
- The finding of the full spectrum of multimers differentiates type 2M from type 2A VWD.
- A decreased ratio of VWF:RCo to VWF:Ag helps distinguish type 2M from type 1.
- The multimer studies may also show an abnormal banding pattern within each individual multimer
- variants that were previously classified as types IC and ID are examples
- Variants with larger than normal multimers in plasma ("Vicenza" variant)
- variants that contain the propeptide in the multimers have been included in type 2M, although it may be more appropriate to classify these variants as type 1.
- A number of patients with decreased collagen binding are also classified as type 2M
- type 2N (N for Normandy), mutations affecting binding of f.VIII with rapid clearance
- uncommon, autosomal recessive trait
- type of bleeding associated with factor VIII deficiency, such as soft tissue, joint, and urinary bleeding, and bleeding after invasive procedures
- symptomatic: inherited homozygous mutation or second VWF defect causing decreased synthesis of the second allele
- since concentration of VWF monomers is higher than of factor VIII, the concentration of functional VWF has to fall considerably <50%
- some patients are misdiagnosed as hemophilia A
- should be suspected in females who present with isolated factor VIII deficiency (with normal levels of VWF activity and antigen) and in families where an autosomal (rather than X-linked) inheritance pattern for factor VIII deficiency is suggested [8,9].
- diagnostiek:
- Ristocetin cofactor activity, VWF antigen, RIPA, and VWF multimer patterns are normal
- factor VIII reduced, usually 5 to 15 percent
- specialized test to assess binding of normal factor VIII to the patient's VWF demonstrates decreased binding
- gene mutation will reveal abnormalities in the VWF binding domain for factor VIII
- type 3, rare, severe bleeding involving skin and mucous membranes (due to decreased VWF) and soft tissues and joints (due to the low concentration of factor VIII)
- marked decrease or absence of VWF due to homozygous or compound heterozygous mutations
- with use of VWF propeptide assays a number of type 3 patients have been reclassified as severe type 1: very high clearance
- diagnostiek:
- VWF antigen is unmeasurable or extremely low
- Ristocetin cofactor activity is usually below the limits of detection
- Factor VIII activity is 1 to 10 percent of normal
- RIPA is absent
- VWF multimers are not usually visible on gel electrophoresis, as in lane 1 of the figure (picture 1).
- type 2A, 10-15%, voornamelijk kleine moleculen
7.2 Bernard-Soulier
- rare
- defect GP-Ib (receptor vWF)
- seemingly large platelets/MGK
- afwijkende ristocetine test (geen reactie op plasma / vWF)
- verward met type 1 or type 2M VWD bij abnormale RIPA zonder dat ristocetin cofactor level bekend is
7.3 Glanzmann
- defect GP-IIb (receptor fibrine)
- ristocetine normaal, rest aggregatietsten niet
- plaatjesrefractoriteit leiden door antistoffen na immunisatie
8 References
- Friberg L, Rosenqvist M, Lip GY. Evaluation of risk stratification schemes for ischaemic stroke and bleeding in 182 678 patients with atrial fibrillation: the Swedish Atrial Fibrillation cohort study. Eur Heart J 2012; 33:1500.
- Lip GY, Nieuwlaat R, Pisters R, et al. Refining clinical risk stratification for predicting stroke and thromboembolism in atrial fibrillation using a novel risk factor-based approach: the euro heart survey on atrial fibrillation. Chest 2010; 137:263.
- January CT, Wann LS, Alpert JS, et al. 2014 AHA/ACC/HRS Guideline for the Management of Patients With Atrial Fibrillation: A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the Heart Rhythm Society. J Am Coll Cardiol 2014; 64:e1.