Acute myeloide leukemie (niet zijnde APL)
Inhoudsopgave
- 1. Onderzoek
- 1.1. Onderzoek specifiek bij AML
- 1.2. IFT
- 1.3. Standaarddiagnostiek acute leukemie
- 1.4. Blastenpercentage
- 1.5. Classificatie AML
- 1.5.1. AML with recurrent genetic abnormalities (requiring ≥10% blasts in BM or PB)
- 1.5.2. Categories designated AML (if ≥20% blasts in BM or PB) or MDS/AML (if 10-19% blasts in BM or PB)
- 1.5.3. anders
- 1.5.4. Diagnostic qualifiers (bv. AML with myelodysplasia-related cytogenetic abnormality, therapy-related)
- 1.6. MRD
- 2. Therapie
- 3. Prognose
- 4. Erfelijke predispositie
- 5. Risicoclassificatie
- 6. Frailty-score
- 7. Moleculaire diagnostiek
- 8. Toekomst
- 9. Referenties
Terug naar beginpagina de-heer.eu.
1 Onderzoek
1.1 Onderzoek specifiek bij AML
- lichamelijk onderzoek:
- skin (bleeding symptoms, leukemia cutis, Sweet syndrome)
- gingival hyperplasia
- lymphadenopathy
- testis enlargement
- signs of infection (eg, pulmonary, perianal, mouth/teeth)
- skin (bleeding symptoms, leukemia cutis, Sweet syndrome)
- eerdere chemo/toxinen, eerdere mailgniteit, roken, sibs
- FA en overweeg kiemceldiagnostiek bij verdenking erfelijke MDS/AML-predispositie
- indien >65 frailty-score (evt. via ouderengeneeskundige), allo haalbare kaart?
- aPTT/PT en indien afwijkend complete DIS-screening
- IFT op MRD
- moleculair
- binnen 3-5 dagen: FLT3 (TDK en ITD), IDH1, IDH2, NPM1, PML::RARA, CBFB::MYH11, RUNX1::RUNX1T1, KMT2A rearrangements, BCR::ABL1
- binnen 1e cyclus: CEBPA (in frame bZIP), DDX41, TP53, ASXL1, BCOR, AZH2, RUNX1, SF3b!, SRSF2, STAG2, U2AF1, ZRSR2, BCR-abl
- evt. voor monitoring (tenzij pre-malignant clonal hematopoiesis, eg, DNMT3A, TET2, ASXL1): ANKRD26, BCORL1, BRAF, CBL, CSF3R, DNMT3A, ETV6, GATA2, JAK2, KIT, KRAS, NRAS, NF1, PHF6, PPM1D, PTPN11, RAD21, SETBP1, TET2, WT1
- vooralsnog geen NGS
- binnen 3-5 dagen: FLT3 (TDK en ITD), IDH1, IDH2, NPM1, PML::RARA, CBFB::MYH11, RUNX1::RUNX1T1, KMT2A rearrangements, BCR::ABL1
- LP na klaren van blasten uit perifeer bloed, indien
- L >100 (NCCN: >40; compromis: bij risicofactoren / op MDO bespreken)
- verdenking CZS-lokalisatie / focale klachten (numb chin)
- extramedullaire ziekte
- blastaire dendritische neoplasie
- L >100 (NCCN: >40; compromis: bij risicofactoren / op MDO bespreken)
- standaarddiagnostiek acute leukemie
- CT-thorax bij verdenking longinfectie
- CT/MRI-hersenen: clinical symptoms suspicious of CNS involvement
1.2 IFT
| IFT bij AML | |
|---|---|
| Diagnosis of AML | |
| Precursor marker | CD34, CD117, HLA-DR |
| Myeloid markers | Cytoplasmic MPO, CD33, CD13 |
| Myeloid maturation | CD11b, CD15, CD64, CD65 |
| Monocytic markers | CD14, CD36, CD64, CD4, CD38, CD11c |
| Megakaryocytic | CD41 (glycoprotein IIb/IIIa), CD61 (glycoprotein IIIa), CD36 |
| Erythroid markers | CD235a (glycophorin A), CD71, CD36 |
| Diagnosis of MPAL | |
| Myeloid lineage | MPO (flow cytometry, immunohistochemistry or cytochemistry), or |
| monocytic differentiation (at least 2 of the following: non-specific esterase cytochemistry, CD11c, CD14, CD64, lysozyme), or | |
| at least two myeloid markers, ie, CD177, CD33, CD13 | |
| T-lineage | Strong cytoplasmic CD3 (with antibodies to CD3 ε chain) or surface CD3 |
| B-lineage | Strong CD19 with at least one of the following strongly expressed: cytoplasmic CD79a, cCD22 or CD10, or |
| weak CD19 with at least two of the following strongly expressed: CD79a, cCD22 or CD10 | |
| MRD markers | |
| CD34, CD117, CD45, CD33, CD13, CD56, CD7, HLA-DR | |
| If monocytic: CD64, CD11b, CD4 (in addition) |
1.3 Standaarddiagnostiek acute leukemie
- morfologie PB (verdenking APL?! dan spoed-PCR PML-RARa)
- algemeen lab
- indien relevant zwangerschapstest
- tumorlysislab (urinezuur, HCO3-, lactaat, PO4-, Ca+)
- bloedgroep
- verdenking hyperviscositeit: fundoscopie, X-thorax
- bij behandeling met HIC of demethylerende therapie
- beenmergonderzoek
- aspiraat, immunofenotypering
- botbiopt
- prognostisch / predictief onderzoek
- karyotypering (2 mL beenmerg first-pull in heparine; bij bloed: 2x 10 mL, buiten kantooruren op kamertemperatuur bewaren)
- moleculair onderzoek (2 mL beenmerg first-pull in EDTA, bij bloed: 2x 10 mL EDTA)
- karyotypering (2 mL beenmerg first-pull in heparine; bij bloed: 2x 10 mL, buiten kantooruren op kamertemperatuur bewaren)
- aspiraat, immunofenotypering
- ECG en X-thorax
- HBV, HCV, HIV
- premenopauzale vrouw: zwangerschapstest, anticonceptie tot half jaar na behandeling, fertiliteitsbesparende ingreep bespreken
- overweeg orgametril
- man: anticonceptie tot half jaar na behandeling, overweeg semenpreservatie
- indien afkomstig uit endemisch gebied of expositie aan open tuberculose in verleden
- Mantoux
- bij snelle start immuunsuppressie: IGRA
- Mantoux
- indien afkomstig uit endemisch gebied: Strongyloidesserologie
- focus gebit
- bij meteen klinisch therapie: icc kaakchirurgie/tandheelkunde
- bij poliklinische behandeling: consult eigen tandarts, zeker bij lang geen tandartsbezoek of klachten
- bij meteen klinisch therapie: icc kaakchirurgie/tandheelkunde
- beenmergonderzoek
- bij behandeling met HIC
- indien >45 of cardiale klachten: ejectiefractie / GSA-scan (of echo cor)
- cumulatieve dosis anthracycline / cardiale comorbiditeit / RT thorax
- dag voor start behandeling: echogeleide CVL (trombo's tevoren >50)
- z.s.m. risicoclassificatie
- indien >45 of cardiale klachten: ejectiefractie / GSA-scan (of echo cor)
1.4 Blastenpercentage
- Let op: bij specifieke moleculaire of cytogenetisch afwijkingen moet vanaf 10% blasten al de diagnose AML gesteld worden
- ook kan het tot de nieuwe diagnose MDS/AML leiden: ligt op de grens tussen MDS en AML, kan als beide ziekten behandeld worden
- ook kan het tot de nieuwe diagnose MDS/AML leiden: ligt op de grens tussen MDS en AML, kan als beide ziekten behandeld worden
- Welke cellen tellen als blasten?
- Myeloblasts, monoblasts and megakaryoblasts
- Monoblasts and promonocytes in AML with monocytic or myelomonocytic differentiation.
- Promyelocytes in the setting of PML::RARA or variant RARA rearrangement.
- Myeloblasts, monoblasts and megakaryoblasts
- Bij eerdere diagnose MPN is de diagnose accelerated phase (10%-19% blasts) or blast phase (≥20% blasts) MPN.
- Bij eerdere diagnose MDS/MPN (eg, CMML), wordt de diagnose MDS/MPN ook pas gesteld bij ≥20% blasten; wel wordt bij een AML-defining recurrent genetic abnormality (eg, KMT2A rearrangement or NPM1 mutation) en blastenpercentage ≥10% AML-therapie aangeraden.
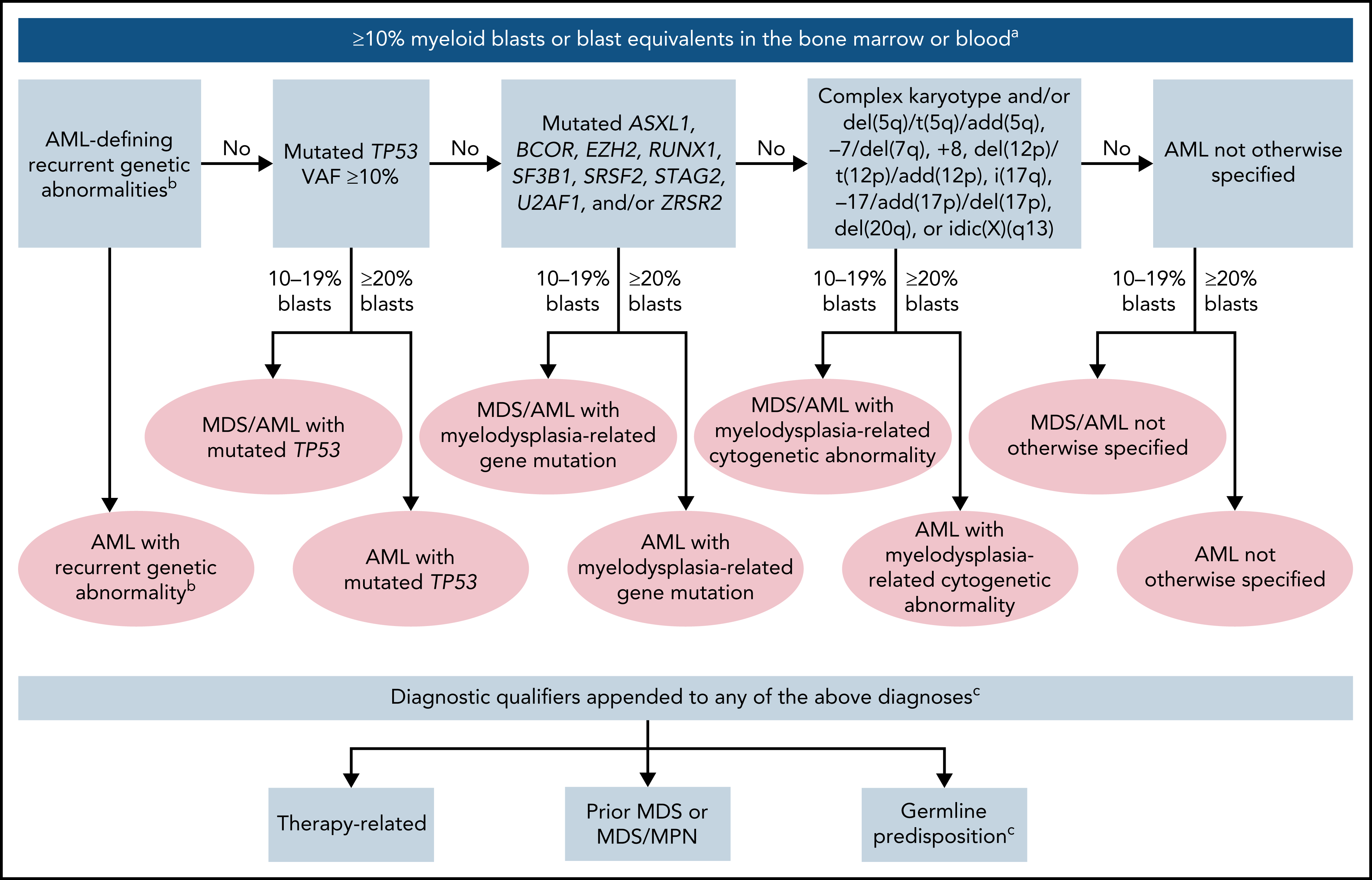
1.5 Classificatie AML
1.5.1 AML with recurrent genetic abnormalities (requiring ≥10% blasts in BM or PB)
-APL with t(15;17)(q24.1;q21.2)/PML::RARA†
-AML with t(8;21)(q22;q22.1)/RUNX1::RUNX1T1
-AML with inv(16)(p13.1q22) or t(16;16)(p13.1;q22)/CBFB::MYH11
-AML with t(9;11)(p21.3;q23.3)/MLLT3::KMT2A‡
-AML with t(6;9)(p22.3;q34.1)/DEK::NUP214
-AML with inv(3)(q21.3q26.2) or t(3;3)(q21.3;q26.2)/GATA2, MECOM(EVI1)§
-AML with other rare recurring translocations‖
-AML with mutated NPM1
-AML with in-frame mutated CEBPA in bZIP domain, mono or biallelic ¶
-AML with t(9;22)(q34.1;q11.2)/BCR::ABL1*
The entity is named with the specific genetic abnormality.
.
- † APL with t(1;17)(q42.3;q21.2)/IRF2BP2::RARA
- APL with t(5;17)(q35.1;q21.2)/NPM1::RARA
- APL with t(11;17)(q23.2;q21.2)/ZBTB16::RARA
- APL with cryptic inv(17) or del(17)(q21.2q21.2)/STAT5B::RARA
- STAT3::RARA
- other genes rarely rearranged with RARA: TBL1XR1 (3q26.3); FIP1L1 (4q12); BCOR (Xp11.4).
- APL with t(5;17)(q35.1;q21.2)/NPM1::RARA
- ‡ AML with t(4;11)(q21.3;q23.3)/AFF1::KMT2A
- AML with t(6;11)(q27;q23.3)/AFDN::KMT2A
- AML with t(10;11)(p12.3;q23.3)/MLLT10::KMT2A
- AML with t(10;11)(q21.3;q23.3)/TET1::KMT2A
- AML with t(11;19)(q23.3;p13.1)/KMT2A::ELL
- AML with t(11;19)(q23.3;p13.3)/KMT2A::MLLT1.
- AML with t(6;11)(q27;q23.3)/AFDN::KMT2A
- § AML with t(2;3)(p11∼23;q26.2)/MECOM::?
- AML with t(3;8)(q26.2;q24.2)/MYC, MECOM
- AML with t(3;12)(q26.2;p13.2)/ETV6::MECOM
- AML with t(3;21)(q26.2;q22.1)/MECOM::RUNX1.
- AML with t(3;8)(q26.2;q24.2)/MYC, MECOM
- ‖ Other rare recurring translocations: AML with t(1;3)(p36.3;q21.3)/PRDM16::RPN1
- AML (megakaryoblastic) with t(1;22)(p13.3;q13.1)/RBM15::MRTFA
- AML with t(3;5)(q25.3;q35.1)/NPM1::MLF1
- AML with t(5;11)(q35.2;p15.4)/NUP98::NSD1
- AML with t(7;12)(q36.3;p13.2)/ETV6::MNX1
- AML with t(8;16)(p11.2;p13.3)/KAT6A::CREBBP
- AML with t(10;11)(p12.3;q14.2)/PICALM::MLLT10
- AML with t(11;12)(p15.4;p13.3)/NUP98::KMD5A
- AML with NUP98 and other partners
- AML with t(16;21)(p11.2;q22.2)/FUS::ERG
- AML with t(16;21)(q24.3;q22.1)/RUNX1::CBFA2T3
- AML with inv(16)(p13.3q24.3)/CBFA2T3::GLIS2.
- AML (megakaryoblastic) with t(1;22)(p13.3;q13.1)/RBM15::MRTFA
1.5.2 Categories designated AML (if ≥20% blasts in BM or PB) or MDS/AML (if 10-19% blasts in BM or PB)
- AML with pathogenic somatic mutated TP53 (VAF >9%, with or without loss of the wild-type TP53 allele)
- AML with myelodysplasia-related gene mutations
- Defined by mutations in ASXL1, BCOR, EZH2, RUNX1, SF3B1, SRSF2, STAG2, U2AF1, and/or ZRSR2
- Defined by mutations in ASXL1, BCOR, EZH2, RUNX1, SF3B1, SRSF2, STAG2, U2AF1, and/or ZRSR2
- AML with myelodysplasia-related cytogenetic abnormalities and the absence of other AML-defining disease categories: complex karyotype: ≥3 unrelated chromosome abnormalities in the absence; excludes hyperdiploid karyotypes with three or more trisomies (or polysomies) without structural abnormalities. Unbalanced clonal abnormalities: del(5q)/t(5q)/add(5q); −7/del(7q); +8; del(12p)/t(12p)/(add)(12p); i(17q), −17/add(17p) or del(17p); del(20q); and/or idic(X)(q13).
- AML not otherwise specified
1.5.3 anders
- Myeloid sarcoma
- Acute leukemia of ambiguous lineage
- Acute undifferentiated leukemia
- MPAL with t(9;22)(q34.1;q11.2)/BCR::ABL1
- MPAL with t(v;11q23.3)/KMT2A-rearranged
- MPAL, B/myeloid, not otherwise specified
- MPAL, T/myeloid, not otherwise specified
- Acute undifferentiated leukemia
- Myeloid proliferations related to Down syndrome
- Transient abnormal myelopoiesis associated with Down syndrome
- Myeloid leukemia associated with Down syndrome
- Transient abnormal myelopoiesis associated with Down syndrome
- Blastic plasmacytoid dendritic cell neoplasm
1.5.4 Diagnostic qualifiers (bv. AML with myelodysplasia-related cytogenetic abnormality, therapy-related)
- Aangezien recent onderzoek geen verschil in prognose / therapie suggereert
- Therapy-related (prior chemotherapy, radiotherapy, immune interventions)
- more common subtype: in ∼75% of cases, 5 to 7 years after first exposure to alkylating agents or radiation, often preceded by MDS, frequently chromosome 5 and/or 7 abnormalities, complex karyotype, and TP53 mutations
- after treatment with topoisomerase II inhibitors, with breakage at topoisomerase II sites involving KMT2A at 11q23.3, RUNX1 at 21q22.1, or RARA at 17q21.2, latency often 1 to 3 years, antecedent MDS is rare
- CHIP (or PPM1D), positive selection by cytotoxic therapy
- deleterious mutations typical of familial cancer predisposition in the homologous recombination DNA repair pathway, particularly BRCA1, BRCA2, PALB2, TP53, or CHEK2
- more common subtype: in ∼75% of cases, 5 to 7 years after first exposure to alkylating agents or radiation, often preceded by MDS, frequently chromosome 5 and/or 7 abnormalities, complex karyotype, and TP53 mutations
- Progressed from MDS (confirmed by standard diagnostics and >3 mo prior to AML diagnosis)
- Progressed from MDS/MPN (specify type, confirmed by standard diagnostics and >3 mo prior to AML diagnosis)
- Germline predisposition (specify type)
- Therapy-related (prior chemotherapy, radiotherapy, immune interventions)
1.6 MRD
- imperfect, beide kanten op, ook bij MRD-positiviteit kan recidief uitblijven
- Mol-MRD at low levels (CRMRD-LL) may be without prognostic significance, therefore negative operationally if the MRD values are below the threshold linked to prognosis, e.g. in CBF-AML and NPM1-mutant AML
1.6.1 Moleculaire MRD
- qPCR of dPCR, limit of detection: at least 10−3
- peripheral blood or bone marrow, sensitivity in blood generally lower by an order of magnitude
- suitable: mutated NPM1; CBFB::MYH11, RUNX1::RUNX1T1, KMT2A::MLLT3, DEK::NUP214, and BCR::ABL1 gene fusions; and WT1 expression
- validation most robust for NPM1, as well as CBFB::MYH11 and RUNX1::RUNX1T1-positive AML
- exclude germline mutations
- NGS onvoldoende, dan lifest error-corrected targeted panel-based approaches
1.6.2 IFT op MRD
- termen: MFC (multiparameter flow cytomettry), LAIP (leukemia-associated aberrant immunophnotype)
- moet core MRD markers bevatten, CD34+/CD38low met aberrante marker niet aanwezig op normale HSC's (CD45RA, CLL-1, CD123)
- experimenteel
- DfN (different from normal) is algemener geformuleerd markerpatroon
2 Therapie
2.1 Algemeen
- verdenking APL: meteen ATRA, desnoods op SEH
- indien aanwezig behandeling spontaan TLS
- overweeg vitamine K-antagonisten/NOAC over te zetten op therapeutisch/profylactische LMWH
- dag voor start behandeling: echogeleide CVL (trombo's tevoren >50)
- low dose chemotherapie indien primaire behandeling niet <24 uur gestart wordt bij L >30
- doel L <30
- hyperleukocytose (L >100) of leukostase: 2dd 3 gram hydroxyureum (Grund et al., UpToDate)
- L >30: 1dd 3 gram hydroxyureum
- indien brug naar decitabine: cave antagonerende werking op decitabine (Choi et al.)
- alternatief indien orale toediening niet mogelijk: 500 mg cytarabine i.v. à 3 uur
- doel L <30
- contra-indicatie bloedtransfusie bij L >50, bij dwingende alleen na leukaferese en a 4 uur
- aanvullende preventieve maartregelen bij hyperleukocytose (L> 100)
- TR-grens >30
- dexamethason 2dd 10 mg 3 dagen
- breedspectrum antibiotica
- hydroxyureum/low dose Ara-C tot L <30 niet per se beter dan meteen hoge dosis chemotherapie (Ali, Hem Onc, 2016)
- frequente controles
- cave leukostase (m.n. bij monocytaire leukemie)
- kliniek: symptomen van m.n. CZS, ogen en longen, maar in theorie alle organen, pseudohypoxemie, pseudohyperkaliëmie
- diagnostiek: fundoscopie (papiloedeem, gedilateerde vaten en retinabloedingen)
- beleid: tenzij APL of DIS overweeg leukaferese ondanks geen bewijs effectiviteit (Huls et al.)
- kliniek: symptomen van m.n. CZS, ogen en longen, maar in theorie alle organen, pseudohypoxemie, pseudohyperkaliëmie
- TR-grens >30
- bij therapie
- anti-emetica: primperan 10 mg z.n. 3dd, zofran 8 mg 2dd
- tumorlysisprofylaxe: hyperhydratie en allopurinol, bij aanvullende risicofactoren: fasturtec
- bij menstruerende vrouw: orgametril 10 mg 1dd
- premenopauzale vrouw: anticonceptie tot half jaar na behandeling, fertiliteitsbesparende ingreep bespreken
- man: anticonceptie tot half jaar na behandeling, semenpreservatie
- bij hoge dosis therapie
- hypromellose 6dd beiderzijds in de ogen druppelen
- zie antibiotische profylaxe in HIC-protocol
- hypromellose 6dd beiderzijds in de ogen druppelen
- anti-emetica: primperan 10 mg z.n. 3dd, zofran 8 mg 2dd
- cave B1-deficientie door verbruik, overweeg thiamine 1dd 100 mg
2.2 Eerste lijn
- indien p53 bekend: overweeg decitabine/venetoclax, ook op jonge leeftijd
- 65 of jonger: 7+3, twee hoge dosis kuren (HOVON 150/156) plus consolidatie met curatieve intentie
- beenmergpunctie dag 17-28 na start 1e kuur (en na kuur 2 indien geen CR), vermijd aspiraat tijdens hematologisch herstel, indien niet conclusief wekelijks herhalen
- FLT3
- midostaurin toevoegen (Stone, NEJM, 2017), onafhankelijk hoogte percentage (richtlijn EMC)
- HOVON 156: 1 jaar onderhoud gilteritinib versus midostaurin
- midostaurin toevoegen (Stone, NEJM, 2017), onafhankelijk hoogte percentage (richtlijn EMC)
- IHD1/2: HOVON 150 (2 jaar onderhoud ivosidenib versus enasidinib)
- bij refractaire AML na kuur 1: venetoclax + decitabine op compassionate use basis
- CR na 2 kuren: consolidatie volgens ELN 2017 (Dohner, Blood, 2017)
- beenmergpunctie dag 17-28 na start 1e kuur (en na kuur 2 indien geen CR), vermijd aspiraat tijdens hematologisch herstel, indien niet conclusief wekelijks herhalen
- 66+: keuze tussen 7+3 (als bij 66-) en demethylerende therapie met venetoclax
- responskans bij 7+3 50% en bij decitabine 35% (+ venetoclax 66%, OS +5m)
- doel bij beide t/m 70 jaar: curatie indien allo-kandidaat
- grove regel: 7+3, tenzij
- frail
- wens patient: lengte opname, acute toxische mortaliteit, morbiditeit (alopecia, mucositis)
- risicoclassificatie: monosomaal karyotype en/of p53: decitabine
- dus wachten indien mogelijk, neutropenie geen reden niet te wachten
- frail
- responskans bij 7+3 50% en bij decitabine 35% (+ venetoclax 66%, OS +5m)
- unfit
- 70+: aza-ven
- moleculaire afwijking
- p53: monotherapie HMA
- IDH1: aza/ivosidenib
- p53: monotherapie HMA
- 70+: aza-ven
- MPAL of blastaire dendritische celneoplasie
- ALL-schema gevolgd door allo
- bij BCR-abl: TKI toevoegen
- onvoldoende respons: AML-schema
- ALL-schema gevolgd door allo
- chloroom of leukemia cutis
- therapie als AML
- zonder BM-betrokkenheid: RT als consolidatie-therapie
- met BM-betrokkenheid: allo als consolidatie-therapie
- therapie als AML
2.3 Na eerste lijn
- unfit of poor risk: overweeg afzien van therapie
- overweeg allo
- eerder geen allo: reinductie gevolgd door allo (hoge dosis cytarabine, of onderstaand)
- eerder wel allo: reinductie en DLI indien alle van de volgende criteria:
- geen actieve GvHD
- geen acute graad III-IV GvHD of chronische extensive GvHD gehad
- geen recidief <6 maanden na allo
- Breems-score A of B
- geen actieve GvHD
- eerder geen allo: reinductie gevolgd door allo (hoge dosis cytarabine, of onderstaand)
- studiedeelname
- verschillende opties
- bij chloroom: RT
- IDH2-mutatie: enasidinib indien verkrijgbaar
- azacitidine/decitabine, overwegingen:
- 20-30% blasten of L <15: voorkeur azacitidine
- p53: voorkeur decitabine (niet vergelijkend uitgezocht)
- 20-30% blasten of L <15: voorkeur azacitidine
- lage dosis chemotherapie
- geen poor risk: low dose ara-C (palliatie: enkele maanden voordeel t.o.v. supportive care)
- M4-M5: etoposide te overwegen
- NPM1-gemuteerde AML: Actinomycine-D te overwegen
- 12,5 µg/kg in 100 ml NaCl 0,9%; inlooptijd 15 minuten; 5 opeenvolgende dagen, elke 3-4 weken
- 12,5 µg/kg in 100 ml NaCl 0,9%; inlooptijd 15 minuten; 5 opeenvolgende dagen, elke 3-4 weken
- geen poor risk: low dose ara-C (palliatie: enkele maanden voordeel t.o.v. supportive care)
- venetoclax:
- CR/CRi 19%, bij UDH 34% (konopleva, Cander Discov, 2016)
- met demethylerende therapie CR/CRi 67% (Dinardo, Blood, 2019)
- met LD-Arac 29 mg/m2 d 1-10 q28 CR/CRi 54%, OS 10 maanden (beter bij CR/CRi)
- voor post-transplantatie situatie vooralsnog te veel vragen over veiligheid
- CR/CRi 19%, bij UDH 34% (konopleva, Cander Discov, 2016)
- bij chloroom: RT
supportive care
- transfusie
- hydroxyureum, vooral zinvol bij
- snel oplopende blastenpercentage
- hoge tumorload
- snel oplopende blastenpercentage
The presence of detectable MRD before transplant is an independent unfavorable predictor of posttransplant outcome.97-100 However, there is currently no evidence showing benefit of additional courses of intensive chemotherapy prior to transplant in CR1 patients who are MRD positive. If fit enough, such patients should be considered candidates for a myeloablative conditioning (MAC) regimen or an early taper of posttransplant immunosuppression.
- transfusie
3 Prognose
- 7+3 tussen de 65-70
- gunstig: CR% 60, sterfte inductie 10%
- intermediate: CR% 50, sterke inductie 30%
- ongunstig: CR% 20, sterfte inductie >50%
- zonder risicoclassificatie
- 50% kans op respons, 20% duurzame respons (>2 jaar), geen genezing zonder allo
- +/- 2 m intensieve behandeling, aanzienlijke kans op ziek worden
- 10-20% mortaliteit
- 50% kans op respons, 20% duurzame respons (>2 jaar), geen genezing zonder allo
- gunstig: CR% 60, sterfte inductie 10%
- palliatieve zorg: prognose 2-3 maanden
4 Erfelijke predispositie
- kans bij AML >5%
- kans ~10% bij t-AML of indien jonger <40 jaar
- kunnen de novo ontstaan
- gaan soms gepaard met andere tumoren, cytopenie
- zie Raaijmakers, NTVH, 2018
- some disorders are associated only with myeloid malignancies (eg, CEBPA), whereas others confer risk to a variety of hematopoietic malignancies and solid tumors.
4.1 Beleid
- voorkomen onnodige therapie (zoals splenectomie/IST bij verkeerde diagnose ITP)
- geen autologe maar allogene SCT
- soms juist geen allo vanwege orgaanschade (longfibrose)
- geen familiedonor (zeker bij RUNX1 en CEBPA) tenzij deze bewezen het defect niet heeft
- geen cyclo/busulfan/TBI ?
- counseling of patients prior to treatment of their primary disease
- cancer/organ surveillance strategies
- cascade testing within families
4.2 Indicaties NGS
- specifieke mutaties beenmerg: CEBPA, Tp53, RUNX1, bij VAF >30-40 tot 60%
- welke genen? ref
- positieve FA: NGS en bij afwijkingen kiemceldiagnostiek overwegen als
- 1 1e gr familielid of 2 2e gr hemat maligniteit of langdurige cytopenie/AA
- Personal history of ≥2 cancers, 1 of which is a hematopoietic malignancy (order does not matter)
- Personal history of a hematopoietic malignancy plus:
- Another relative within two generations with another hematopoietic malignancy, or
- Another relative within two generations with a solid tumor diagnosed at age 50 or younger, or
- Another relative within two generations with other hematopoietic abnormalities
- Another relative within two generations with another hematopoietic malignancy, or
- 1 1e gr familielid of 2 2e gr hemat maligniteit of langdurige cytopenie/AA
- AA <40, MDS <40
- Presence of a deleterious gene variant in tumor profiling that could be a germline allele, especially if that variant is present during remission (CHEK2 I200T and truncating DDX41 variants altijd)
- ondergenoemde typische orgaanafwijkingen
- lymfoedeem, doofheid sensineuraal, grijs <30, nagelafwijkingen, hypo/hyperpigmentatie
- bloedingn / quantitative and qualitative platelet defects: ANKRD26, ETV6, and RUNX1.
- GATA2 with immunodeficiency, wratten
- Shwachman Diamond syndrome with exocrine pancreas insufficiency and skeletal dysplasia
- Fanconi anemia with facial dysmorphism, squamous cell carcinomas, and liver tumors
- Dyskeratosis congenita with pulmonary fibrosis, liver cirrhosis, and vascular anomalies
- lymfoedeem, doofheid sensineuraal, grijs <30, nagelafwijkingen, hypo/hyperpigmentatie
4.3 Germline status of a variant is confirmed by
- Its presence in DNA derived from a tissue source not likely to undergo somatic mutation frequently (eg, cultured skin fibroblasts or hair follicles) AND at a variant allele frequency consistent with the germline (generally considered between 30-60%), or
- Its presence in at least two relatives at a variant allele frequency consistent with the germline
- Only pathogenic and likely pathogenic variants are considered causative of disease and are followed clinically in families, this classification changes over time however.
5 Risicoclassificatie
| autoloog (of 3e kuur) | favorable (èn bij NPM1-positiviteit: MRD-negatief) |
| intermediate/MRD- | |
| allo-SCT | intermediate/MRD+ |
| adverse |
- voor indeling zie ELN 2017
- verder geldt als "adverse"
- leeftijd >65 jaar (ook bij gunstige cytogenetica)
- geen CR na 1 kuur bij intermediate risk
- hyperviscositeit?
- leeftijd >60-65
- leeftijd >65 jaar (ook bij gunstige cytogenetica)
6 Frailty-score
- frail als:
- HCT-CI >2
- 3MS <77
- SPPB <9
- HCT-CI >2
- HCT-CI >2
- +/- 50% populatie
- +/- 30% toxische mortaliteit (studie MDACC)
- +/- 50% populatie