AL-amyloidose
Inhoudsopgave
Terug naar beginpagina de-heer.eu.
1 Onderzoek
- onderzoek bij verdenking amyloidose
- zie "eenvoudig onderzoek bij diagnostiek bij diagnose AL-amyloidose"
- waarbij pro-BNP heel weinig specifiek is en beter vervangen kan worden door CK-MB
- vetbiopt
- evt. orgaandiagnostiek/biopt
- zie "eenvoudig onderzoek bij diagnostiek bij diagnose AL-amyloidose"
- indicaties overwegen diagnostiek
- non-BJ proteïnurie
- restrictieve cardiomyopathie met DC, ritme- en/of geleidingsstoornissen met syncope (of door laag slagvolume/RR)
- syncope na starten ACE-i
- polyneuropathie en/of autonome neuropathie, o.a. orthostase en gastro-intestinale klachten
- carpaal tunnelsyndroom
- macroglossie, periorbitale hematomen (Raccoon eyes), huidbloedingen hals
- onbegrepen diarree/obstipatie, gewichtsverlies, organomegalie lever/milt
- non-BJ proteïnurie
- diagnostiek bij diagnose AL-amyloidose
- eenvoudig onderzoek
- algemeen lab plus aPTT/PT
- X-thorax
- ECG: lage QRS voltages (Musselini et al.), pseudo-infarct patroon, eerstegraads-AV-blok, P top afwijkend, verlengde QTc
- 24-uurs urine op eiwit (non-BJ proteïnurie >0,5 g) en kreat –> evt. biopt
- trop-T (>39 p/mol) en pro-BNP (>332 ng/L) zonder nierfalen of BF –> evt. echo/MRI cor (gem LV-wanddikte >12 mm bij geen HT of AoS, typisch: LVEF behouden) –> biopt
- echo/CT lever (>15 cm zonder hartfalen of AF 1,5x ULN) –> SAP-scan/biopt
- algemeen lab plus aPTT/PT
- invasiever onderzoek
- uitsluiten MM of LPL
- BM-aspiraat: morfologie (% pc/LPL-cellen) en IFT
- biopt: beoordeling % pc/LPL-cellen, MYD88, Congoroodkleuring
- cytogenetica: del(17p), en 1q+, 14q32, als afwijkend: t(11;14), t(4;14), t(14;16), tevens
- CT-skelet (cave dubbelbeeld AL-CRAB)
- BM-aspiraat: morfologie (% pc/LPL-cellen) en IFT
- evt. EMG (m.n. sensibele polyneuropathie)
- evt. orthostase meten (of Ewing batterij)
- darmklachten of afvallen –> gastro/colo met biopten
- uitsluiten MM of LPL
- eenvoudig onderzoek
- diagnostische criteria
- systemische AL-amyloidose
- amyloid middels Congo-roodkleuring vastgesteld
- dat daadwerkelijk ook functiestoornis orgaan veroorzaakt
- en getypeerd wordt als AL-amyloid (met anti-k/l immunohistochemie, ELISA tegen AA/AL/ATTR, electronenmicroscopie of massa-spec)
- bij plasmaceldyscrasie
- in >1 lokalisatie (minstens 1 PA-aangetoond, andere loksalisaties mogen non-invasief zijn aangetoond)
- amyloid middels Congo-roodkleuring vastgesteld
- ATTR-amyloidose
- biopt, of
- o.b.v. skeletscintigrafie (99mTc-HDP, -DPD of -PYP)
- graad 2 of 3 cardiale opname volgens Perugini
- afwezigheid van een M-proteïne in serum/urine en verhoogde VLK in bloed
- graad 2 of 3 cardiale opname volgens Perugini
- biopt, of
- systemische AL-amyloidose
- prognostisch onderzoek
- >10% plasmacellen
- dVLK >180 (of <50)
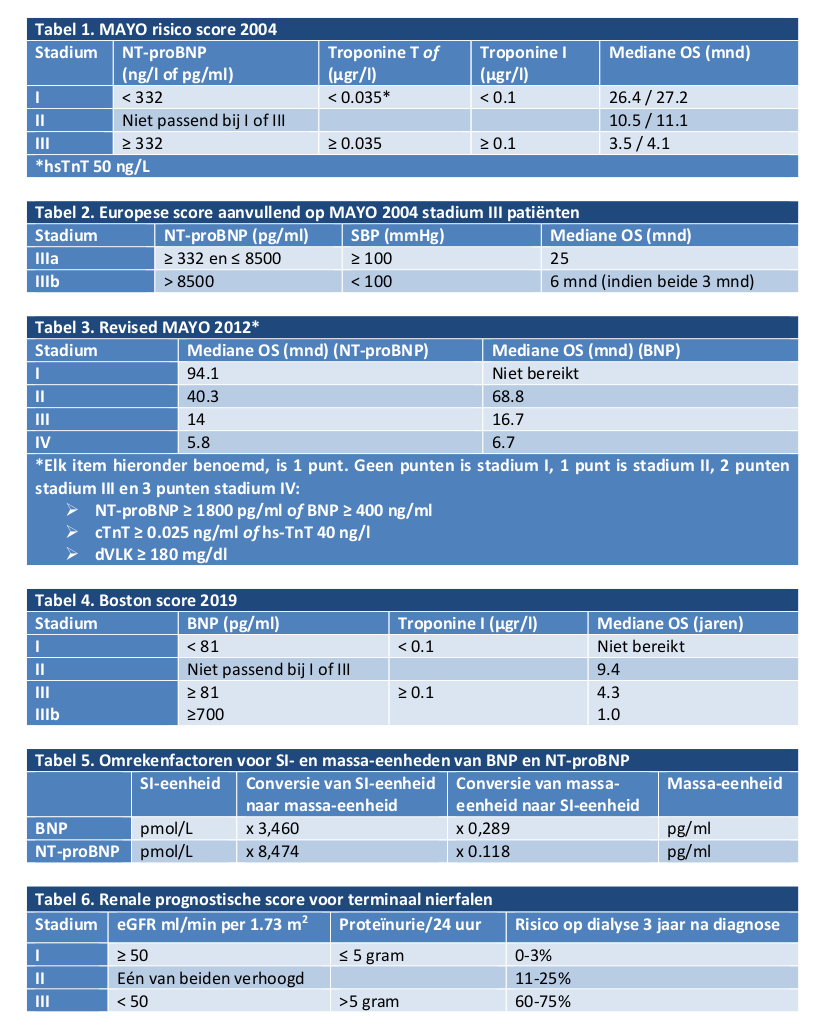
- cardiale betrokkenheid: revised Mayo system
- hematologische respons
- m.b.t. terminaal nierfalen: eGFR <50 en >5 gram proteinurie
- cytogenetica geen prognostischewaarde, relatief vaak t(11;14) gevonden: goede respons op Bcl2-remming maar niet op bortezomib
- >10% plasmacellen
2 Therapie
- progressie naar MM zeldzaam, wel calcium vervolgen en bij pijn CT-skelet
- bij therapie frequent hematologische respons (zie responsclassificatie) en orgaanrespons bepalen
- bij progressie of geen PR met 2-3 kuren op eerstelijns behandeling: tweedelijns therapie
- overweeg stoppen bij stabiele CR of na 2x jaar therapie
- en denk aan afwijkende therapie bij orgaandysfunctie, zie onder, o.a.
- geen RAAS-remming bij cardiale betrokkenheid en hypotensie of bortezomib
- voorzichtiger met antistolling
- geen antistolling bij nefrotisch syndroom (wel evt. statine)
- afwijkende therapie hartfalen/ritmestoornis
- cave QT-tijd bij profylaxe
- doxycycline bij hartfalen
- geen RAAS-remming bij cardiale betrokkenheid en hypotensie of bortezomib
- cave bijnierinsufficientie bij hypotensie
- bij atriumfibrilleren altijd DOAC en geen CHADSvASC berekenen
2.1 intensieve therapie
- 3-4x DCyBorD, stamcelmobilisatie middels G-CSF (aferese dag +4), HDM 200 mg/m2 3 weken na ferese
- geen lenalidomide-onderhoud i.v.m. ontbreken van bewijs voor langere overleving en al goede en langdurige responsduur na ASCT
- selectiecriteria AuSCT
- Leeftijd: ≤70 jaar
- ECOG-PS: tot 2
- NYHA: 1 of 2
- NT-proBNP: <5000 pg/ml of <590 pmol/L (=ng/L)
- BNP: <500 pg/ml = <145 pmol/l
- Troponine T of Troponine I: ≤0.06 ug/L of ≤0.1 ng/mL
- Ejectie fractie cor: ≥45%
- Bloeddruk: Systole ≥90 mmHg
- eGFR: ≥30 ml/min/ 1.73m2 of dialyse (geen absoluut criterium)
- Bilirubine: ≤2x ULN
- Symptomatische effusie: niet aanwezig
- Leeftijd: ≤70 jaar
2.2 niet intensieve eerste lijn
- CyBorD: 65% respons, 43% VGPR, 17% cardiale respons, 25% renale respons
- pijnlijke of graad >1 polyneuropathie
- LenDex: 43% VGPR/CR (zie hieronder bij lenalidomide)
- MelDex: 76% respons, 31% CR, 37% cardiale respons, cave toxiciteit bij ernstige cardiale toxiciteit
- LenDex: 43% VGPR/CR (zie hieronder bij lenalidomide)
- intolerantie cyclofosfamide
- BorMelDex
- BorMelDex
- pijnlijke of graad >1 polyneuropathie
2.3 tweede en verdere lijn
- algemeen
- bij progressie of onvoldoende respons op eerstelijns behandeling orgaandysfunctie niet afwachten: geeft betere overleving
- mediaan orgaanverslechtering
- 6 maanden na een stijging van 50% van de dVLK bij 85% van de patiënten
- mediaan 14 maanden bij subtielere stijging na diepe en langdurige respons na ASCT
- 6 maanden na een stijging van 50% van de dVLK bij 85% van de patiënten
- bij progressie of onvoldoende respons op eerstelijns behandeling orgaandysfunctie niet afwachten: geeft betere overleving
- opties
- herhalen eerste lijn bij langdurige en diepe respons
- verder geen voorkeur
- IMID: 50% respons, tijd tot respons van 2 maanden
- LenDex (geen monotherapie!), zie hieronder bij specifieke middelen
- PomDex
- LenDex (geen monotherapie!), zie hieronder bij specifieke middelen
- proteasoomremmer
- ixazomib: 50% respons, 20% CR
- minder orgaanfalen en overlijden (dan physician best choice)
- minder orgaanfalen en overlijden (dan physician best choice)
- bortezomib: RR 68%, tijd tot respons mediaan 3 weken
- 1.6 mg/m2 op dg 1, 8, 15 en 22 in een 35 daags schema
- frequent dosisreducties, mediane aantal cycli 8
- 1.6 mg/m2 op dg 1, 8, 15 en 22 in een 35 daags schema
- ixazomib: 50% respons, 20% CR
- daratumumab monotherapie: 76% respons, 36% CR, tijd tot respons 1 maand
- langer dan 1 maand (4x) geven niet zinvol
- duur therapie?
- langer dan 1 maand (4x) geven niet zinvol
- herhalen eerste lijn bij langdurige en diepe respons
2.4 individuele middelen
- bortezomib: snelle respons, proteasoom al overbelast door amyloidose
- lenalidomide: respons duurt lang (>2 cycli), 15 mg maximale dosis, 85% kans op stijgen cardiale markers (zonder toename orgaanstoornis hart)
- carfilzomib: relatief veel cardiopulomale bijwerkingen?
- thalidomide: veel polyeneuropathie en obstipatie, slaperigheid, cardiale bijwerkingen (decompensatie en ritmestoornissen)
2.5 responsmeting
- hematologische respons meting
- na ieder kuur en daarna iedere 3 maanden
- VLK als dVLK >50, anders M-proteine indien >5 g/L, 1-2% geen marker: BMP niet betrouwbaar
- cave invloed nierfunctie / HT op VLK
- bij >50% patienten met PR volgt ook orgaanrespons
- tijdig ingrijpen als geen PR: na 3 cycli (of 2 indien cardiaal sterk belast)
- stoppen
- bij stabiele CR, ook bij immunomodulerende imide drugs (IMiD) en anti-CD38 therapie
- bij totale behandelingsduur van maximaal 2 jaar bij immunomodulerende imide drugs (IMiD) en anti-CD38 therapie
- bij stabiele CR, ook bij immunomodulerende imide drugs (IMiD) en anti-CD38 therapie
- na ieder kuur en daarna iedere 3 maanden
- orgaanresponsbepaling
- iedere 3 maanden tijdens actieve behandeling
- cardiale enzymen/RR, levergrootte, klaring, proteinurie, leverproeven, albumine
- iedere 3 maanden tijdens actieve behandeling
- 1-2 jaarlijks beeldvorming indien afwijkend bij start tot stabilisatie
- hart (MRI of echocardiografie), echo lever en eventuele SAP-scan
- hart (MRI of echocardiografie), echo lever en eventuele SAP-scan
2.5.1 orgaanresponscriteria
- lever (cave decompensatie als verklaring verandering)
- respons:
- vermindering van ≥50% van afwijkende waarde alkaline phosphatase serum, of
- vermindering van de levergrootte met meer dan 2 cm
- vermindering van ≥50% van afwijkende waarde alkaline phosphatase serum, of
- progressie: toename ≥50% van alkaline phosphatase serum berekend vanaf laagste waarde
- respons:
- nier
- respons
- ≥30% vermindering totaal eiwit in 24 uurs urine, of
- vermindering totaal eiwit naar <0.5 gr/dag zonder verslechtering nierfunctie (≥25% toename start serum creatinine en 25% vermindering van eGFR)
- ≥30% vermindering totaal eiwit in 24 uurs urine, of
- progressie: 25% vermindering eGFR
- respons
- hart (cave IMID/dexa/decompensatie/kreat-stijging als verklaring):
- respons
- vermindering van NT-proBNP van ≥30% en minimaal >300 ng/L (35 pmol/L) berekend vanaf startwaarde in patiënten met een NT-proBNP >650 ng/L (77 pmol/L), of
- NYHA stadium verbetering van minimaal 2 stadia in patiënten met NYHA 3 of 4
- vermindering van NT-proBNP van ≥30% en minimaal >300 ng/L (35 pmol/L) berekend vanaf startwaarde in patiënten met een NT-proBNP >650 ng/L (77 pmol/L), of
- progressie
- Toename NT-proBNP ≥30% en minimaal >300 pg/ml (35 pmol/L) vanaf laagste waarde. Alleen indien geen verslechtering nierfunctie (≥25% toename start serum creatinine en 25% vermindering van eGFR), of
- Toename Troponine ≥33%, of
- Daling ejectiefractie van ≥10% (absoluut)
- Toename NT-proBNP ≥30% en minimaal >300 pg/ml (35 pmol/L) vanaf laagste waarde. Alleen indien geen verslechtering nierfunctie (≥25% toename start serum creatinine en 25% vermindering van eGFR), of
- respons
- ventrikelwanddikte en zenuwonderzoek niet: zelden verbetering
2.5.2 responsclassificatie
- CR:
- serum en 24 uurs urine negatief voor M-proteïne bepaald met immuunfixatie
- normale absolute waarde van de betrokken lichte keten (laatste alleen nodig bij patiënten met GFR ≥60 ml/min)
- echte CR: ook VLK-ratio normaal
- Modified CR: geen genormaliseerde VLK-ratio vanwege suppressie van urine-VLK (Bence-Jones) beneden de ondergrens van normaal (VLK-ratio abnormaal of normaal)
- serum en 24 uurs urine negatief voor M-proteïne bepaald met immuunfixatie
- VGPR: dVLK <40 mg/L
- Partiele respons: ≥50% afname dVLK
- Geen respons: minder dan PR, geen progressie
- Progressie:
- Vanaf CR; abnormale VLK-ratio en verdubbeling absolute waarde van betrokken VLK (vanaf laagste waarde) of weer meetbaar M-proteïne
- Vanaf start therapie, PR of geen respons:
- betrokken VLK waarde stijging van minimaal ≥50% en ook minimaal >100 mg/L, of
- 50% toename M-proteïne en waarde >5 g/L, of
- 50% toename M-proteïne urine >200 mg/dag
- betrokken VLK waarde stijging van minimaal ≥50% en ook minimaal >100 mg/L, of
- Vanaf CR; abnormale VLK-ratio en verdubbeling absolute waarde van betrokken VLK (vanaf laagste waarde) of weer meetbaar M-proteïne
2.5.3 therapie orgaandysfunctie
- nefrotisch syndroom
- lisdiuretica plus spironolacton en zout- en vochtrestrictie
- HT (zeldzaam): ACE remmers of AII-antagonisten tenzij cardiale betrokkenheid en hypotensie of bortezomib
- cholesterolverlagers bij hypercholesterolaemie
- geen antistolling gezien het bloedingsrisico en omdat niervenetrombose in de praktijk zelden wordt gezien
- dialyse bij geen ernstig hartfalen verbetert de overleving: HD soms lastig door hypotensie
- transplantatie is mogelijk
- lisdiuretica plus spironolacton en zout- en vochtrestrictie
- hartfalen
- meestal HFpEF dus vullingstatus behouden
- lisdiuretica/spironolacton
- indien ook verminderde LVEF matige prognose
- geen ACEi: slecht verdragen (hypotensie), nut onduidelijk
- lisdiuretica/spironolacton
- atriumfibrilleren, atriumflutter, ventriculaire ritmestoornissen
- B-blokkade mogelijk maar voorzichtig: kan hartfalen verergeren (gefixeerd slagvolume: hartfrequentie bepaalt cardiac output)
- amiodarone redelijk getolereerd
- digitalis kan met lagere startdoseringen en onder strikte controle
- Ca-antagonisten afgeraden: slecht voorspelbaar effect op geleiding, prikkelbaarheid en contractiekracht
- als gebruikelijk antistolling
- cave QT-tijd
- routinematige ICD afgeraden (vaak brady of EMD probleem), pacemaker als bij iedereen, harttransplantatie niet mogelijk
- B-blokkade mogelijk maar voorzichtig: kan hartfalen verergeren (gefixeerd slagvolume: hartfrequentie bepaalt cardiac output)
- doxycycline (2 dd 100mg) bij hartfalen (stadium IIIa) mogelijk levensverlengend door interferentie amyloïdfibrilformatie
- http://www.bloodjournal.org/content/126/23/732?sso-checked=true
- loopt prospectieve studie (https://clinicaltrials.gov/ct2/show/NCT03474458)
- minimaal 6 maanden tot een jaar
- door bijwerkingen niet altijd verdragen.
- http://www.bloodjournal.org/content/126/23/732?sso-checked=true
- meestal HFpEF dus vullingstatus behouden
- autonome neuropathie: hypotensie, verergerd door diuretica en ACE-remming
- d.d. zelden bijnierinsufficientie door amyloiddepositie
- therapie: houdings- en bewegingsadviezen en steunkousen
- fludrocortison: niet bij diureticagebruik
- midodrine: alpha-1 agonist, lijkt meest effectief, 2,5 mg 3dd tot maximaal 15 mg 3dd, niet vergoed
- fludrocortison: niet bij diureticagebruik
- d.d. zelden bijnierinsufficientie door amyloiddepositie
- bloedingen
- vasculopathie door gegeneraliseerde amyloïddeposities in de bloedvaten
- stollingsstoornis, met name factor X
- gebruikelijk antistolling individueel afwegen tegen bloedingsrisico
- vasculopathie door gegeneraliseerde amyloïddeposities in de bloedvaten
- darmklachten: bloedingen, malabsorptie, motiliteitsstoornissen als pseudo-obstructie
- buikpijn d.d. autonome neuropathie, amyloïddepositie, medicatie, hartfalen, obstipatie, bijnierinsufficientie
- diarree: imodium en octreotide, evt. antibiotica (bacteriële overgroei)
- bijvoeding, zelden TPV
- buikpijn d.d. autonome neuropathie, amyloïddepositie, medicatie, hartfalen, obstipatie, bijnierinsufficientie
- niet zonder meer reden vaccinaties
3 Prognose
4 Varia
- typen amyloidose
- wild type Amyloïd Transthyretine (ATTR)-amyloïdose
- erfelijke ATTR-amyloïdose
- serum amyloïd A (AA)-amyloïdose
- nog 70 anderen..
- wild type Amyloïd Transthyretine (ATTR)-amyloïdose
- 70-80% is AL amyloidose:
- lichte ketens slaan door conformatieverandering neer met serum amyloid-P als fibrillen
- 80% t.g.v. afwijkend lambda, vaak <10% plasmacellen
- geen M-proteine/VLK/uLC AL-amyloidose: sluit diagnose uit, maar niet de andere amyloidosen
- lichte ketens slaan door conformatieverandering neer met serum amyloid-P als fibrillen
- diagnostic delay gemiddeld 15 maanden
- PET-CT: systemisch amyloid is PET-negatief (Glaudemans et al.)
- SAP-scan, nut:
- behulpzaam bij klinische verdenking amyloïdose maar als biopt negatief is of twijfelachtig
- opsporen amyloïd lever en milt
- “amyloïdload” kwantificeren ten behoeve van follow-up
- niet geschikt voor: evaluatie van cardiale betrokkenheid
- behulpzaam bij klinische verdenking amyloïdose maar als biopt negatief is of twijfelachtig
- ook passend bij AL-amyloidose
- gewrichtsklachten (evt. SAP/MRI)
- heesheid
- huidafwijkingen
- lymfadenopathie
- xerostomie
- kaakclaudicatio (amyloïd in de kleinere vaten: angina pectoris, beenclaudicatio)
- periorbitale hematomen (uiting van vasculopathie)
- droge hoest/dyspnoe (HR-CT > biopt)
- autonome dysfunctie:
- orthostase
- collaps
- mictieproblemen
- slikproblemen
- maagontledigingsstoornis
- intestinale pseudo-obstructie
- erectiele disfunctie
- orthostase
- gewrichtsklachten (evt. SAP/MRI)