Lymfoplasmocellulair lymfoom, LPL / Waldenström
Terug naar beginpagina de-heer.eu.
1 Onderzoek
- laboratoriumonderzoek inclusief M-proteine, b2-microglobuline en stolling
- CT hals t/m abdomen (osteolytische lesies: past niet bij LPL)
- PET-CT als:
- curatieve intentie / stadium I-II (non-existent?)
- verdenking transformatie
- typisch: stijging LDH, snelle progressie, extranodale lokalisatie, klieren/organomegalie
- SUV gemiddeld 15 i.p.v. 7
- cave amyloidose bij afvallen
- beenmergonderzoek met MyD88, indien negatief, d.d.
- sediment: als screening amyloidose en cryo's
- prognose: rIPSS-WM (of www.awmrisk.com bij smouldering LPL)
- diagnostische criteria
- evt.
- cryo's bij
- atypische klachten: vasculitis/ulcera, neuropathie, nefropathie, Raynaud, acrocyanose, Raynaud
- hyperviscositeit
- CAD bij acrocyanose, Raynaud, livedo, ulceratie, koude-intolerantie
- lichte ketens alleen als: onbegrepen nierfunctietoornis, cryo's of verdenking amyloidose
- nierbiopt: bij verdenking WM-gerelateerde nefropathie of nefrotisch syndroom (amyloidose, LCDD, cast, cryo's, IgM-deposities)
- screening hyperviscositeit incl. fundoscopie bij
- IgM >60
- bijpassende kliniek: hoofdpijn, visus, verward, dyspnoe, bloedneus, coma
- zeker bij cryos's (vals-verlaagd IgM bij koude afname)
- vWF bij bloeding (cave ook ITP/amyloidose)
- anti-MAG bij polyneuropathie
- LP en MRI-hersenen bij verdenking Bing-Neel
- antifosfolipiden (IgM-gerelateerd) bij trombose
- i.c.c. neurologie bij onbegrepen neurologie (polyneuropathie [amyloidose, cryo's MAG-antistoffen], anti-GM1-antistoffen, antidecorine-myopathie, Bing-Neel)
- niet:
- CXCR4 (incidentie 40%)
- zowel nonsense mutaties en frameshift mutaties
- bij mutatie: hoger IgM, meer kans op hyperviscositeitssyndroom, minder lymfadenopathie
- bij nonsense mutatie bij ibrutinib tragere en minder diepe responsen
- cytogenetica: kan helpen bij d.d. MM (vaak t11;14 en niet hij WM, bij WM bij 40% 6q-)
1.1 klachten
- klieren/organomegalie: transformatie, amyloidose
- ijzergebrek: door hoog hepcidine of verlies in tr.digestivus
- hartfalen: AL amyloidose, LCDD
- huidproblemen: urticaria/Schnitzler, tumorinfiltratie, amyloidose, CAD, cryo's
- maagdarmklachten: amyloidose, tumorinfiltratie, IgM depositie
2 Therapie
2.1 Algemeen
- let op: primary cold agglutinin-associated lymphoproliferative disease valt onder CAD
- geen gerandomiseerde studies
- geen consensus volgorde behandelregimes
- meer dan helft overlijdt (leeftijd >70) aan andere oorzaak dan Waldenström
- daarom per patient goed te verwachten toxiciteit versus diepte respons afwegen
- aan concentratie IgM / M-proteine niet absoluut belang hechten bij beoordeling respons
- laagdrempelig andere responsparameters controleren zoals ook percentage infiltratie bij beenmergonderzoek
- vanwege (vertraagde) flare op rituximab / lange halfwaardetijd IgM
- soms nog jaren na staken chemotherapie daling IgM
- indicatie therapie
- als laaggradig lymfoom
- bij IgM >60 uitsluiten hyperviscositeit ook middels fundoscopie
- indien negatief: nauwlettende monitoring incl. herhaalde fundoscopie
- plasmaferese bij hyperviscositeit, kan vaak pas na 1-2 cycli snel werkende chemo gestopt worden
- in principe vincristine vermijden gezien hoge kans op polyneuropathie
- indicaties internationaal: Hb <6,2 of TR <100 of maximale diameter klier >5 cm of ziektegerelateerde klachten
2.2 Rituximab
- in principe altijd rituximab toevoegen aan chemotherapie (niet aan ibrutinib): verlengt PFS/OS
- maar pas geven bij IgM <40 (of lager indien bij lagere waarde hyperviscositeit)
- flare tot 4 maanden na start mogelijk
- m.n. bij monotherapie: dan bij 25% ≥25% stijging van het IgM (en bij 50% enige stijging)
- kan ook snel na start behandeling beginnen (<1 maand) en soms maandenlang aanhouden (meestal tot 4 maanden)
- alternatief: flare opvangen met plasmaferese
- geen onderhoudsbehandeling rituximab
- indien progressie binnen (6-)12 maanden na laatste rituximab: geen rituximab meer toevoegen
- bij intolerantie
- herhalen met maximale ondersteuning, zie richtlijn
- door type I allergische reactie desensitisatie mogelijk
2.3 Schema's
- 6x DRC21 met 1x 1000 mg/m2 cyclofosfamide i.v.
- beste balans toxiciteit / effectiviteit: 80% PR, PFS 35m; recidief: 70% PR, PFS 32m
- trage respons: kan tot 4 maanden duren
- even effectief maar minder myelosuppressief/toxisch dan R-CVP/CHOP
- bij gebruik vincristine namelijk meer kans op pnp dan normaal
- DRC ook mogelijk na andere behandeling in eerste lijn?
- 6x R-bendamustine (niet vergoed!)
- laagdrempelig 4 kuren van maken, lijkt effectiviteit nl. niet te verminderen
- 95% respons, PFS 65m; recidief: 80%, PFS 13-58m
- snelste en meest effectieve respons wat betreft PFS/diepte
- wel fysiek zwaarder dan DRC
- argumenten voor R-benda: hoge tumorload (in beenmerg of klieren), behoefte aan snelle respons / lange PFS, IgM >40
- op oudere leeftijd dosisreductie: 70 mg/m2
- indien R-refractair ook effectief zonder R
- evt. bij kwetsbare patient
- rituximab monotherapie 4x q 1 week bij contra-indicatie chemo of geringe tumorload
- PFS 20m, RR 35%; recidief: PFS-30m 22%
- trage respons
- R-bortezomib/dexamethason (niet vergoed!)
- snelle respons, effectiever dan DRC, RR 70%, PFS 45m; recidief: RR 50%, PFS 15m
- minder toxisch dan bendamustine
- maar hoge kans op polyneuropathie: 1x/week toepassen
- indien R-refractair ook effectief zonder R
- ibrutinib 420 mg/zanabrutinib (zana niet vergoed!)
- snelle respons, RR 75%, PFS-2j 85%; recidief: RR 73%, PFS-2j 70% en PFS-5j 80%
- vergoed in eerste lijn indien niet-fit
- effectiefst bij geen wt-MyD88 (en geen CXCR4-mutatie)
- nadeel gebruik tot progressie en hoge kosten: i.p. pas bij R- of chemorefractoriteit
- let op, met leeftijd grotere kans op: bloeding, AF, HT
- contra-indicatie: ernstige bloeding in VG en dubbele antistolling
- in principe niet
- R-chloorambucil q 28 dagen tot maximale respons plus 2 kuren
- respons trager dan bij DRC
- ORR 50% en PFS 27 maanden
- relatief veel neutropenie en secundaire maligniteiten
- geen data over toevoeging R
- fludara/cladribine
- effectief
- toxisch: cytopenie, infectie, secundaire maligniteit, transformatie
- lenalidomide: leidt tot ernstige anemie
- thalidomide: veel polyneuropathie
- alemtuzumab: veel toxiciteit
2.3.1 Recidief
- zelfde schema's als boven waarbij
- >3 jaar respons: therapie ook evt. herhalen
- <1 jaar respons:
- allo overwegen indien jong/fit
- indien progressie <12 maanden na laatste rituximab: geen rituximab meer toevoegen
- autologe stamceltransplantatie
- bij geselecteerde patienten met een agressief beloop een optie
- liefst bij 2e recidief of eerder, daarna minder effectief
- PFS 4 jaar
- allo
- beperkte rol
- bij snel recidief na ibrutinib en immunochemotherapie te overwegen
- o.h.a. bij derde recidief of later
2.3.2 Transformatie
- conform behandeling DGBCL (6x R-CHOP + 2x R)
- overweeg AuSCT
- in eerstelijns behandeling bij chemosensitieve ziekte en reeds eerder behandeling voor LPL
- in tweedelijns behandeling
- bij recidief na AuSCT: overweeg allo
2.3.3 IgM-gerelateerde amyloidose
- optimale behandeling niet duidelijk
- gezien doel van diepe remissie in principe zwaardere behandeling dan gebruikelijk bij LPL noodzakelijk
- consolidatie met AuSCT
- verder lijkt beeld op non-IgM amyloidose behoudens
- minder vaak hartfalen
- meer lymfadenopathie
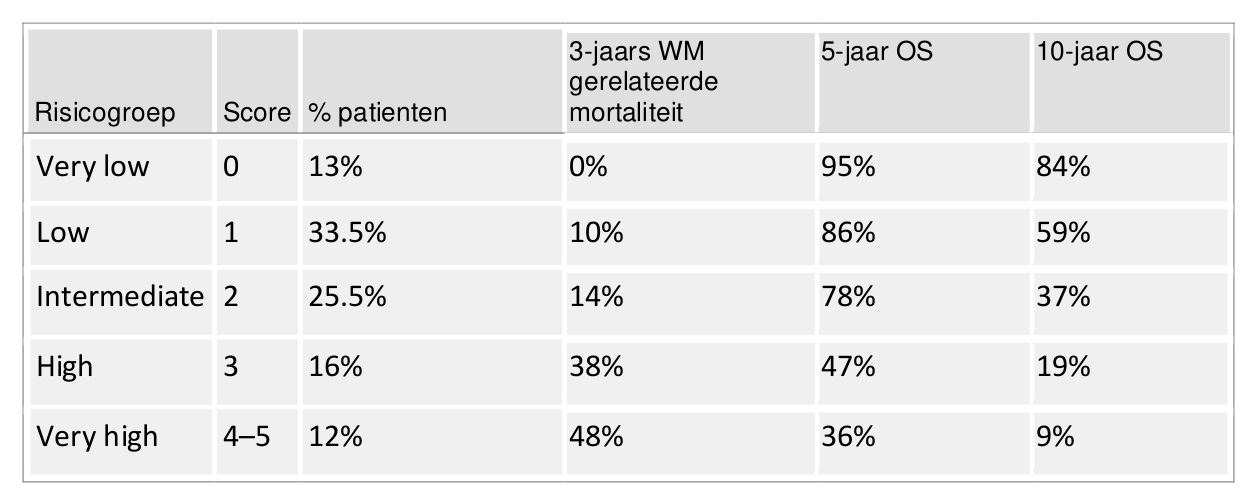
3 Prognose
- voorkeur:
- rIPSS-WM
- www.awmrisk.com bij smouldering LPL
- zie Castillo, BJH, 2014 met duidelijke curves per leeftijdscategorie
- LDH ook van prognostische betekenis
Table 1: r-IPSSWM
| Leeftijd 66-75 jaar |
1 |
| Leeftijd >75 jaar |
2 |
| β2-microglobuline >4 mg/l |
1 |
| LDH > 250 IU/L |
1 |
| Serum albumine < 35 gr/L |
1 |
Table 2: IPSSWM
| leeftijd >65 |
| Hb <11,5 g/dL |
| TR <100 |
| B2M >3 mg/L |
| serum IgM >70 g/L |
4 Diagnostische criteria
- IgM MGUS (1,5% kans op progressie per jaar)
- IgM-proteine <30 g/L
- percentage LPL-cellen beenmerg <10%
- klachten (normaal BB, geen B-symptomen of hypervisc, klieren, organomegalie of andere orgaanschade)
- niet: MGUS
- wel: IgM-gerelateerde ziekte
- LPL
- LPL zonder IgM M-proteine of beenmergbetrokkenheid
- LPL met IgA/IgG
- LPL zonder M-proteine of lichte keten-LPL: amper beschreven
- MW
- IgM-paraproteine
- percentage LPL-cellen beenmerg >9%
- twee vormen
- asymptomatisch / smouldering (50-60% na 5 jaar progressie)
- symptomatisch
5 Varia
- LPL-cellen zijn een verzameling van kleine lyfmocyten, plasmocytoid en plasmacellen
- CAD lijkt een aparte entiteit ten opzichte van WM/IgM gezien de specifieke morfologische, immunohistochemische en moleculaire opmaak van de B cel cloon in het beenmerg
Auteur: Koen de Heer
Created: 2022-12-16 vr 16:37