Myelodysplastisch syndroom, MDS
Inhoudsopgave
Terug naar beginpagina de-heer.eu.
1 Verplicht onderzoek
- anamnese: B-symptomen, functionele cytopenie, auto-immuunfenomenen
- laboratoriumonderzoek
- volledig bloedbeeld inclusief monocyten, reti en MCV
- algemeen SEH-lab inclusief vitamine B12, foliumzuur, LDH, TSH
- beenmergonderzoek: aspiraat, biopt; let op ringsideroblasten en morfologie megakaryo's passend bij 5q-
- indien allogene stamceltransplantatie een optie is (ongeveer <70 en fit): cytogenetica en moleculaire diagnostiek
- volledig bloedbeeld inclusief monocyten, reti en MCV
- indien cytogenetica gedaan is: IPSS en R-IPSS
- indien moleculair onderzoek gedaan is: IPPS-M (of MDS Risk Support)
- overweeg erfelijke MDS/AML-predispositie
- let op:
- blastenpercentage >9: indien verricht zijn er specifieke cytogenetische en moleculaire afwijkingen die bij een blastenpercentage van 10 of hoger tot een diagnose AML leiden (zie hoofdstuk AML)
- ook kan het tot de nieuwe diagnos MDS/AML leiden: liggen op de grens tussen MDS en AML, kan als beide ziekten behandeld worden
- blastenpercentage >9: indien verricht zijn er specifieke cytogenetische en moleculaire afwijkingen die bij een blastenpercentage van 10 of hoger tot een diagnose AML leiden (zie hoofdstuk AML)
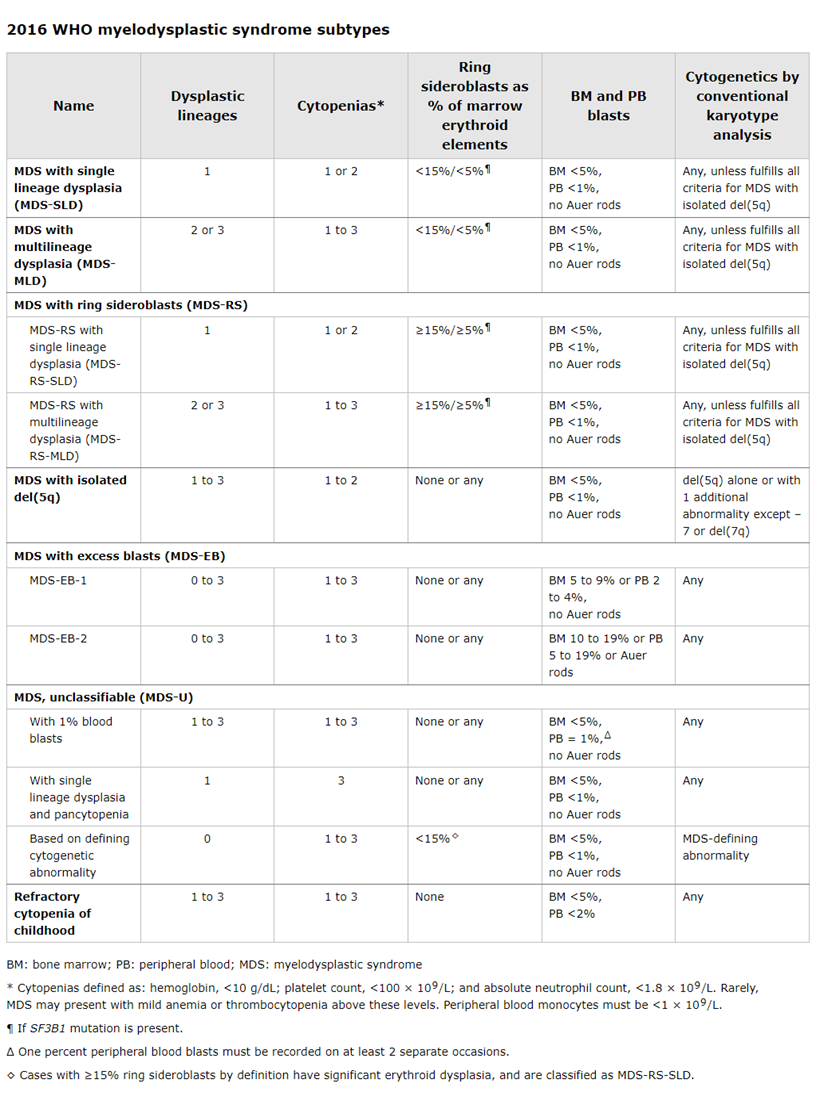
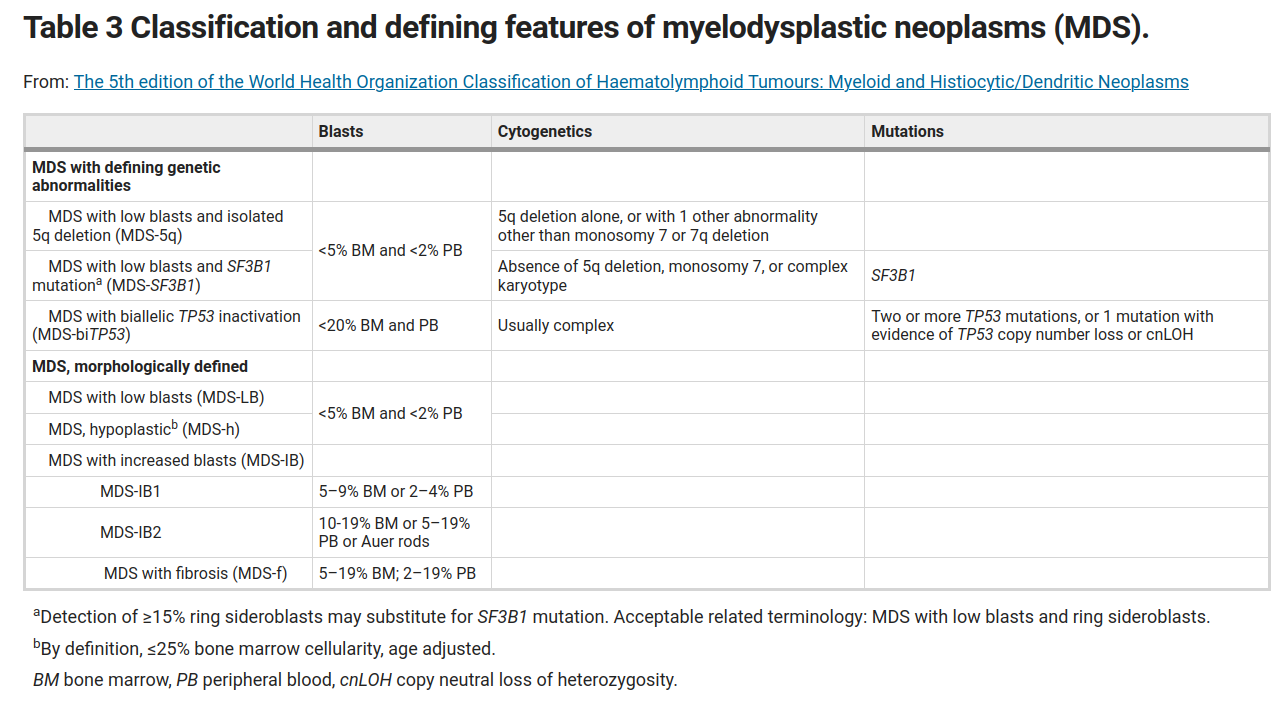
- classificatie:
- WHO 2016
- WHO 2016
1.1 diagnostische criteria:
- Cytopenias
- Hb <6,2
- N <1.8 x 109/L (tenzij BEN)
- Tr <100
- Hb <6,2
- And dysplasia
- Morphologic or immunophenotypic evidence of significant dysplasia in ≥10 percent of erythroid precursors, granulocytes, or megakaryocytes on the blood smear or bone marrow examination, in the absence of other causes of dysplasia
- Morphologic or immunophenotypic evidence of significant dysplasia in ≥10 percent of erythroid precursors, granulocytes, or megakaryocytes on the blood smear or bone marrow examination, in the absence of other causes of dysplasia
1.1.1 Cytogenetic abnormalities
The following chromosomal abnormalities are presumptive evidence of MDS in patients with otherwise unexplained refractory cytopenia and no morphologic evidence of dysplasia:
- Unbalanced chromosomal abnormalities:
- Loss of chromosome 7 or del(7q)
- del(5q) or t(5q)
- Isochromosome 17q or t(17p)
- Loss of chromosome 13 or del(13q)
- del(11q)
- del(12p) or t(12p)
- del(9q)
- idic(X)(q13)
- Loss of chromosome 7 or del(7q)
- Balanced chromosomal abnormalities:
- t(11;16)(q23.3;p13.3)
- t(3;21)(q26.2;q22.1)
- t(1;3)(p36.3;q21.2)
- t(2;11)(p21;q23.3)
- inv(3)(q21q26.2) or t(3;3)(q21.2;q26.2)
- t(6;9)(p23;q34.1)
- t(11;16)(q23.3;p13.3)
- In contrast, the following cytogenetic/molecular findings exclude the diagnosis of MDS and instead are considered diagnostic of AML:
- t(8;21)(q22;q22); RUNX1-RUNX1T1 (previously AML1-ETO)
- inv(16)(p13.1q22) or t(16;16)(p13.1;q22); CBFB-MYH11
- t(15;17)(q22;q21.1); PML-RARA
- t(8;21)(q22;q22); RUNX1-RUNX1T1 (previously AML1-ETO)
- In the absence of dysplasia or abnormal blood counts, other clonal karyotypic changes lack diagnostic specificity and are not sufficient criteria by themselves for a diagnosis of MDS; examples include
- del(Y)
- trisomy 8
- and del(20q)
- del(Y)
2 Therapie
2.1 algemeen
- verandering bloedbeeld: beenmergonderzoek herhalen om transformatie uit te sluiten
- deelname CDK9-studie is mogelijk
2.1.1 trombopenie
- TR <40-50: stoppen antistolling
- bij bloedingsneiging:
- cyklokapron
- overweeg allogene SCT
- cyklokapron
- ernstige bloedingsneiging
- trombo-suppletie
- TPO (niet geregistreerd tenzij diagnose concurrente ITP)
- trombo-suppletie
2.1.2 neutropenie
- herhaalde infecties:
- SDD
- G-CSF
- overweeg allogene SCT
- SDD
2.2 hypocellulaire MDS
- als AA
2.3 indolent MDS
- Hb <6,2: EPO/G-CSF
- 6 weken 1x/3 weken 500 ug proberen
- bij onvoldoende effect: naar 1000 ug 1x/3 weken
- geen plaats voor G-CSF
- suggestie van werkzaamheid bij falen EPO: Hellstrom-Lindberg et al. en Hellstrom-Lindberg et al.
- Cochrane review toont geen effectiviteit, bij toepassing met of zonder chemotherapie
- suggestie van werkzaamheid bij falen EPO: Hellstrom-Lindberg et al. en Hellstrom-Lindberg et al.
- 6 weken 1x/3 weken 500 ug proberen
- MDS with low blasts and SF3B1:
- EPO-naief: Commands-studie (VUmc), luspatercept versus EPO
- transfusie-afhankelijk en na falen/intolerantie EPO: luspatercept (Fenaux, ASH, 2018; kosteneffectief?)
- 100 mg 1dd pyridoxine te proberen
- in principe moet er na 2 weken effect optreden
- veilig te gebruiken gedurende 2 maanden
- in principe moet er na 2 weken effect optreden
- EPO-naief: Commands-studie (VUmc), luspatercept versus EPO
- MDS with low blasts and isolated 5q deletion
- 5q-syndroom: lenalidomide
- 10 mg 3 weken op en 1 week af
- pm afbouwen tot 5 mg
- tot herstel oorspronkelijke hematopoiese 1x/2 weken lab
- te overwegen elke 6 mnden BM herhalen, incl, cytogenetica en NGS om p53 uit te sluiten
- geen indicatie ascal
- 10 mg 3 weken op en 1 week af
2.4 hoog-risico MDS en/of MDS-EB
- in principe pas therapie bij symptomatische ziekte
- opties:
- alloSCT
- <10% blasten: allogene SCT zonder conditionering
- <10% blasten: allogene SCT zonder conditionering
- AML-therapie, evt. gevolgd door AlloSCT (eis: R-IPSS >4,5)
- zie AML, prognostische cijfers ook ongeveer gelijk
- zie AML, prognostische cijfers ook ongeveer gelijk
- azacitidine, evt. gevolgd door AlloSCT (blasten >5% en IPSS 1,5 of hoger)
- +/- 7 dagen achtereen per 28 dagen in ziekenhuis voor injectie
- winst in overleving 3-6 maanden gemiddeld
- kans op verergering afwijkingen bloedbeeld en toename problemen
- +/- 7 dagen achtereen per 28 dagen in ziekenhuis voor injectie
- alloSCT
3 IPSS
| Prognostische variabele | score | ||||
| 0 | 0.5 | 1.0 | 1.5 | 2.0 | |
| BM blasten (%) | <5 | 5-10 | - | 11-20 | 21-30 |
| Karyotype* | Goed | Intermediar | Slecht | ||
| Cytopenieën Hb <6,2 / N <1,8 / TR <100 |
0 of 1 | 2 of 3 |
- cytogenetica
- goed: normaal, -Y, del(5q), del(20q)
- intermediair: anders
- slecht: complex (≥3 afw), afw 7
- goed: normaal, -Y, del(5q), del(20q)
4 R-IPSS
| Prognostic variable | Score | ||||||
| 0 | 0.5 | 1 | 1.5 | 2 | 3 | 4 | |
| Cytogenetics* | Very good | Good | Intermediate | Poor | Very poor | ||
| Bone marrow blast (percent) | ≤2 | >2 to <5 | 5 to 10 | >10 | |||
| Hemoglobin (g/dL) | ≥10 | 8 to <10 | <8 | 8 (=5 mmol/L) | 10 (=6,2 mmol/L) | ||
| Platelets (cells/microL) | ≥100 | 50 to 100 | <50 | ||||
| Absolute neutrophil count (cells/microL) | ≥0.8 | <0.8 |
- cytogenetica
- Very good: -Y, del(11q)
- Good (1 punt): normal, del(5q), del(12p), del(20q), double including del(5q).
- Interm (2 punt): del(7q), +8, +19, i(17q), any other single/double independent clone
- Poor (3 punten): -7, inv(3)/t(3q)/del(3q), double including -7/del(7q), complex: 3 abnormalities.
- Very poor: Complex: >3 abnormalities.
- Very good: -Y, del(11q)
- referentie met survivalcurve
| Risk group | IPSS-R score | Median overall survival (years) | Median time to 25 percent AML evolution (years) |
| Very low | ≤1.5 | 8.8 | >14.5 |
| Low | >1.5 to 3.0 | 5.3 | 10.8 |
| Intermediate | >3 to 4.5 | 3 | 3.2 |
| High | >4.5 to 6 | 1.6 | 1.4 |
| Very high | >6 | 0.8 | 0.7 |
5 studies
| naam | Patienten | Interventie | Controle | Outcome measure | Outcome | n | Auteur | Jaar |
|---|---|---|---|---|---|---|---|---|
| SUPPORT# | TR <75 | Eltrombo+Aza | Aza | TR-Tx-vrij tijdens C1-4 | 16% vs 31% | 356 | Dickenson | 2018 |
| alle | ATG + 2e IST | n.v.t. | FE-Tx-vrij / RR | 30% / 50% | 207 | Stahl | 2018 | |
| MEDALIST$ | FE-Tx | Luspatercept | placebo | FE-tx onafhankelijkheid | 38% vs 13% | 229 | Fenaux | 2020 |
| ASPIRE | TR-Tx | Eltrombo (open) | placebo | thrombocytopenic events | 54% vs 69% | 145 | Mittelman | 2018 |
| EQoL-MDS# | TR <30 | Eltrombopag | placebo | significante TR-stijging | 49% vs 3% | 90 | Oliva | 2017 |
| TR-penie | Romiplostim | placebo | AML / OS | gelijk | 250 | Kantarjian | 2018 | |
| 5q- en FE-Tx | Lena | n.v.t. | FE-Tx-vrij | 67% | 148 | List | 2006 | |
| FE-Tx geen 5q- | Lena | placebo | FE-Tx-vrij | 27% vs 3% | 239 | Santini | 2016 | |
| 5q- en FE-Tx | Lena | placebo | FE-Tx-vrij | 56% vs 42% | 205 | Fenaux | 2011 | |
| high-risk | Aza | BSC | OS mediaan (maanden) | 24,5 vs 15 | 179 | Fenaux | 2009 |
- # Mogelijk meer AML bij gebruik TPO-agonist
- $ Hypocellulair BM / paarden-ATG en ciclo beste respons
6 brieven
6.1 Terugverwijzing eerste lijn
patiënt heeft een asymptomatische MDS met een R-IPSS score van 1. In historische cohorten ging dit gepaard met een overleving van mediaan bijna 9 jaar. Het zou dus goed kunnen dat patiënt nooit klachten van zijn MDS zal ondervinden. Potentiële complicaties betreffen een toename van de anemie of uitbreiding tot een pancytopenie (met door trombopenie een bloedingsneiging of door leukopenie recidiverende/opportunistische infecties). Ook kunnen er B-symptomen en auto-immuunfenomenen ontstaan. En tot slot kan de ziekte over gaan in acute leukemie. Dit betreft echter een minderheid van de patiënten.
In overleg met patiënt zou ik u willen vragen de controles over te nemen. De halfjaarlijkse controles die ik bij patiënt momenteel uitvoer bestaan uit een anamnese en laboratoriumonderzoek (te weten een bloedbeeld, kreatinine en LDH). Bij progressie zijn er -ook op de leeftijd van patiënt- verschillende therapeutische opties. Derhalve zie ik patiënt dan gaarne indien gewenst retour.